题目内容
4.下列解释事实的反应方程式正确的是( )| A. | 亚硫酸钠水溶液显碱性:SO32-+2H2O?H2SO3+2OH- | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 浓NaOH溶液处理少量二氧化硫:SO2+OH-═HSO3- |
分析 A.亚硫酸根离子为多元弱酸根离子,分步水解,以第一步为主;
B.亚硫酸为多元弱酸,分步电离,以第一步为主;
C.碳酸钙和二氧化硫、氧气反应生成硫酸钙和二氧化碳;
D.二氧化硫少量反应生成亚硫酸钠和水.
解答 解:A.亚硫酸钠水溶液显碱性,离子方程式:SO32-+H2O?HSO3-+OH-,故A错误;
B.SO2的水溶液显酸性,离子方程式:SO2+H2O?H2SO3?H++HSO3-,故B错误;
C.燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2,故C正确;
D.浓NaOH溶液处理少量二氧化硫,离子方程式:SO2+2OH-═SO32-+H2O,故D错误;
故选:C.
点评 本题考查了化学方程式、离子方程式的书写,明确反应实质是解题关键,注意多元弱酸分步电离、多元弱碱分步水解,题目难度不大.

练习册系列答案
相关题目
14.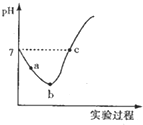 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验过程中可用pH试纸测定溶液的pH | |
| B. | a点的溶液中:C(H+)=c(Cl-)+c(HCl0)+c(OH-) | |
| C. | c 点所示溶液中;c(Na+)=2c(ClO )+c(HCIO) | |
| D. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 |
15.锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门.以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是MnCO3+H2SO4=MnSO4+CO2↑+H2O;
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③抑制Mn2+的水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有烧杯;滤渣2的主要成分是CoS和NiS;
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10-5 mol•L-1,则应保持溶液中c(S2-)≥1.0×10-6 mol•L-1.

已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③抑制Mn2+的水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有烧杯;滤渣2的主要成分是CoS和NiS;
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10-5 mol•L-1,则应保持溶液中c(S2-)≥1.0×10-6 mol•L-1.
9.加入少许下列一种物质,不能使溴水颜色显著变浅的是( )
| A. | Mg粉 | B. | KOH溶液 | C. | KI溶液 | D. | CCl4 |
16.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. | 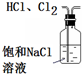 除去HCl中含有的少量Cl2 | B. | 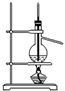 石油的蒸馏 | ||
| C. |  制备乙酸乙酯 | D. |  制备收集干燥的氨气 |
13. 如图所示,打开分液漏斗后,加热,烧杯中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则原烧杯中n(Na2S)与n(Na2SO3)的比值需满足( )
如图所示,打开分液漏斗后,加热,烧杯中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则原烧杯中n(Na2S)与n(Na2SO3)的比值需满足( )
 如图所示,打开分液漏斗后,加热,烧杯中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则原烧杯中n(Na2S)与n(Na2SO3)的比值需满足( )
如图所示,打开分液漏斗后,加热,烧杯中出现黄色沉淀并有臭鸡蛋气味的气体逸出,则原烧杯中n(Na2S)与n(Na2SO3)的比值需满足( )| A. | >2 | B. | <2 | C. | =2 | D. | 1~2之间 |
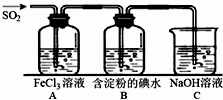 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
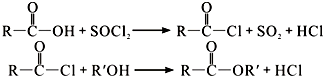
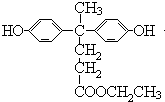
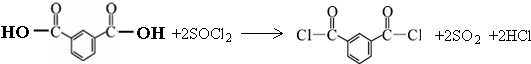
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示: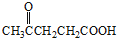 )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):
 .
. 的路线.
的路线. .
.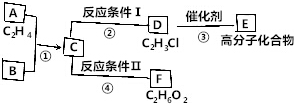 已知:
已知: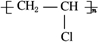 ,FCH2OHCH2OH.
,FCH2OHCH2OH.