题目内容
2.下列溶液中有关物质的量浓度关系不正确的是( )| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| D. | 在浓度均为0.1 mol•L-1Na2CO3、NaHCO3、NH4Cl溶液中c(H+)分别为c1、c2、c3,则c3>c2>c1 |
分析 A.醋酸为弱酸,混合液中醋酸过量,则溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知c(CH3COO-)>c(Na+);
B.二者恰好反应生成硫酸铵、硫酸钠,铵根离子部分水解,溶液呈酸性,则c(H+)>c(OH-)、c(Na+)=c(SO42-)>c(NH4+);
C.根据碳酸氢钠溶液中的质子守恒判断;
D.碳酸钠、碳酸氢钠呈碱性,氯化铵呈酸性,且碳酸钠的水解程度大于碳酸氢钠,据此进行判断.
解答 解:A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合,醋酸过量,则c(H+)>c(OH-),根据电荷守恒可知c(CH3COO-)>c(Na+),溶液中正确的离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A错误;
B.向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中,反应后溶质为等浓度的硫酸铵、硫酸钠,铵根离子部分水解,溶液呈酸性,则c(H+)>c(OH-)、c(Na+)=c(SO42-)>c(NH4+),溶液中离子浓度大小为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故B正确;
C.NaHCO3溶液中,根据质子守恒可得:c(OH-)+c(CO32-)=c(H+)+c(H2CO3),整理可得:c(OH-)-c(H+)=c(H2CO3)-c(CO32-),故C正确;
D.浓度均为0.1 mol•L-1Na2CO3、NaHCO3、NH4Cl溶液中,碳酸钠和碳酸氢钠溶液呈碱性,氯化铵溶液呈酸性,则氯化铵溶液中的氢离子浓度最大;碳酸钠的水解程度大于碳酸氢钠,则碳酸钠溶液的碱性大于碳酸氢钠,则氢离子浓度碳酸钠需要碳酸氢钠,所以c(H+)大小分别为:c3>c2>c1,故D正确;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒的含义为解答关键,注意正确分析反应后溶质组成,A为易错点,注意醋酸为弱酸,混合液呈酸性,试题培养了学生灵活应用基础知识的能力.

| A. | 在任何温度下都能自发进行 | B. | 在任何温度下都不能自发进行 | ||
| C. | 仅在高温下自发进行 | D. | 仅在低温下自发进行 |
| A. | 除去KCl溶液中的少量K2CO3:加入适量的盐酸 | |
| B. | 除去CO2中的少量HCl:通入NaOH溶液 | |
| C. | 除去NaCl溶液中的少量MgCl2:加入适量KOH溶液,过滤 | |
| D. | 除去N2中的少量O2:通过灼热的CuO粉末 |
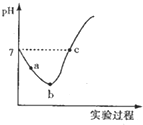 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验过程中可用pH试纸测定溶液的pH | |
| B. | a点的溶液中:C(H+)=c(Cl-)+c(HCl0)+c(OH-) | |
| C. | c 点所示溶液中;c(Na+)=2c(ClO )+c(HCIO) | |
| D. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:,
将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:,
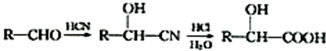
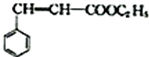
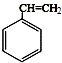 ;C 的化学名称为苯乙醛.
;C 的化学名称为苯乙醛.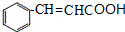 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.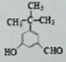
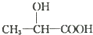 )的路线(其他试剂任选)
)的路线(其他试剂任选)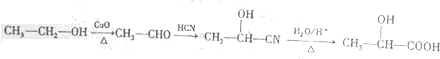 .
.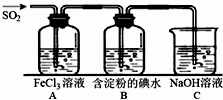 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示: