题目内容
7.NO2与SO2混合可发生反应:NO2+SO2?SO3+NO.I.在100℃1molNO2与1molSO2的混合气体置于绝热恒容密闭容器中发生上述反应,①正反应速率随时间变化的趋势如图所示,则下列说法正确的是C(填字母).
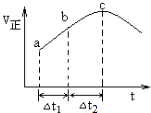
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
②判断此反应达到平衡的标志是ADEF
A.体系的压强不再发生变化 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.各组分的物质的量浓度不再改变
E.体系的温度不再发生变化 F.v(NO2)正=v(NO)逆
II.在常温时,维持体系总压强P恒定体积为V升的1molNO2与1molSO2混合气体于密闭容器发生上述反应.已知NO2的平均转化率为α,则在该温度下反应的平衡常数K=$\frac{{α}^{2}}{({1-α)}^{2}}$(用α,V等符号表示).
(3)熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.试回答下列问题:
①该燃料电池正极电极反应式为:O2+CO2+2e-=CO32-.
②25℃时,某学生想用该燃料电池电解一定量的硫酸钠饱和溶液中进行电解,当电路中有amol电子转移时,溶液中析出mgNa2SO4•10H2O晶体.若温度不变,在剩余溶液中溶质的质量分数为$\frac{71m}{161(m+9a)}$×100%,消耗掉的丁烷在标准状况下的体积为0.86a.
分析 I.①A.反应在达到平衡状态时,反应速率应保持不变;
B.随着反应的进行,反应物浓度越来越小;
C.根据图可知,该反应在绝热条件下进行,反应速率受温度和浓度的因素影响,反应速率先增大后减小,说明该反应为放热反应,先由于温度升高反应速率增大,后浓度下降,反应速率下降,所以反应物的总能量高于生成物的总能量;
D.根据图可知,ab段的速率小于bc段,所以△t1=△t2时,SO2的消耗量:a~b段小于b~c段;
②该反应为气体体积不变的放热反应,在绝热的条件下进行,则体系的温度是不断升高的,直至平衡状态,根据平衡状态的特征:正逆反应速率相等,各组份的分数或浓度保持不变,及某些外部特征不变判断反应是否处于平衡状态;
II.(3)根据反应NO2+SO2?SO3+NO,利用三段式,根据K=$\frac{c(NO)c(SO{\;}_{3})}{c(NO{\;}_{2})c(S{O}_{2})}$计算;
①某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,则正极电极为氧气发生还原反应生成碳酸根离子;
②电解硫酸钠饱和溶液即电解水,所以当电路中有amol电子转移时,消耗的水的质量为$\frac{a}{2}×18$g=9ag,结合析出的mgNa2SO4•10H2O晶体,可计算出原饱和溶液的溶质的质量分数,剩余溶液中溶质的质量分数与原饱和溶液的溶质的质量分数相等,根据原池的负极反应C4H10-26e-+13CO32-=17CO2+5H2O可知,当电路中有amol电子转移时,消耗掉的丁烷的物质的量为$\frac{a}{26}$mol,据此答题.
解答 解:I.①A.反应在达到平衡状态时,反应速率应保持不变,故A错误;
B.随着反应的进行,反应物浓度越来越小,所以反应物浓度:a点大于b点,故B错误;
C.根据图可知,该反应在绝热条件下进行,反应速率受温度和浓度的因素影响,反应速率先增大后减小,说明该反应为放热反应,先由于温度升高反应速率增大,后浓度下降,反应速率下降,所以反应物的总能量高于生成物的总能量,故C正确;
D.根据图可知,ab段的速率小于bc段,所以△t1=△t2时,SO2的消耗量:a~b段小于b~c段,故D错误;
故选C;
②该反应为气体体积不变的放热反应,在绝热的条件下进行,则体系的温度是不断升高的,直至平衡状态,
A.根据上面的分析可知,反应过程中温度升高,体积不变,则体系压强增大,当体系的压强不再发生变化,则说明反应已经处于平衡状态,故A正确;
B.该反应体积不变,质量守恒,所以混合气体的密度不随反应的进行而改变,故不能作为平衡状态的判断标志,故B错误;
C.反应前后质量和物质的量都不变,所以混合气体的平均相对分子质量不能作为平衡状态的判断标志,故C错误;
D.各组分的物质的量浓度不再改变,则反应处于平衡状态,故D正确;
E.根据上面的分析可知,体系的温度不再发生变化,反应处于平衡状态,故E正确;
F.v(NO2)正=v(NO)逆,则反应处于平衡状态,故F正确;
故选ADEF;
II.(3)由于反应中各物质的计量数都是1,且在同一个容器进行反应,所以各物质的浓度关系就可以用物质的量表示,利用三段式,
NO2+SO2?SO3+NO
起始 1 1
转化 α α α α
平衡 1-α 1-α α α
所以K=$\frac{c(NO)c(SO{\;}_{3})}{c(NO{\;}_{2})c(S{O}_{2})}$=$\frac{{α}^{2}}{({1-α)}^{2}}$,
故答案为:$\frac{{α}^{2}}{({1-α)}^{2}}$;
①某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,则正极电极为氧气发生还原反应生成碳酸根离子,电极反应式为O2+CO2+2e-=CO32-,
故答案为:O2+CO2+2e-=CO32-;
②电解硫酸钠饱和溶液即电解水,所以当电路中有amol电子转移时,消耗的水的质量为$\frac{a}{2}×18$g=9ag,结合析出的mgNa2SO4•10H2O晶体,所以原饱和溶液的溶质的质量分数为$\frac{\frac{142}{322}×m}{9a+m}$×100%=$\frac{71m}{161(m+9a)}$×100%,剩余溶液中溶质的质量分数与原饱和溶液的溶质的质量分数相等,也为 $\frac{71m}{161(m+9a)}$×100%,根据原池的负极反应C4H10-26e-+13CO32-=17CO2+5H2O可知,当电路中有amol电子转移时,消耗掉的丁烷的物质的量为$\frac{a}{26}$mol,其体积为$\frac{a}{26}$mol×22.4L/mol=0.86aL,
故答案为:$\frac{71m}{161(m+9a)}$×100%;0.86a.
点评 本题考查电化学和化学平衡知识,内容比较综合,在理解所学各部分化学知识的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体化学问题,本题难度中等,注意守恒思想的运用.

 天天向上口算本系列答案
天天向上口算本系列答案| A. | C2H6 | B. | C2H4 | C. | C3H6 | D. | C6H10 |
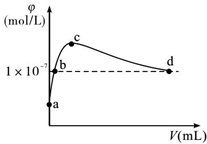 常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )
常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-12mol/L | |
| B. | b点溶液中:c(H+)=1×10-7mol/L | |
| C. | c点溶液中:c(K+)=2[c(CO${\;}_{3}^{2-}$)+c(HCO3-)+c(H2CO3)] | |
| D. | d点溶液中:c(K+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$) |
| A. | 离子键 | B. | 金属键 | C. | 氢键 | D. | 极性共价键 |
| A. | 可用电解饱和的MgCl2溶液的方法获得金属镁 | |
| B. | 电解CuSO4溶液精炼金属铜时,用铁做阳极 | |
| C. | 电解熔融Al2O3方法冶炼金属铝时,同时要加入冰晶石作助熔剂 | |
| D. | 工业上常采用活泼金属还原法冶炼金属银 |