题目内容
2.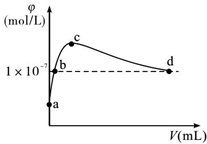 常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )
常温下,将CO2通入2LpH=12的KOH溶液中.溶液中水电离出的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-12mol/L | |
| B. | b点溶液中:c(H+)=1×10-7mol/L | |
| C. | c点溶液中:c(K+)=2[c(CO${\;}_{3}^{2-}$)+c(HCO3-)+c(H2CO3)] | |
| D. | d点溶液中:c(K+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$) |
分析 a点为氢氧化钾溶液,a到c是生成碳酸钾,b点是碳酸钾和氢氧化钾的混合溶液,c点是单一的碳酸钾溶液,c到d是生成碳酸氢钾,d点是碳酸氢钾和碳酸的混合溶液,d点溶液呈中性,
A.a点溶液中的溶质是KOH,水电离出的c(H+)=10-pH;
B.常温下,c(OH-)=1×10-7mol/L,溶液呈中性;
C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钾溶液,根据碳酸钾溶液中的物料守恒判断;
D.d点溶液中,溶液呈中性,溶液中存在电荷守恒,根据电荷守恒判断.
解答 解:a点为氢氧化钾溶液,a到c是生成碳酸钾,b点是碳酸钾和氢氧化钾的混合溶液,c点是单一的碳酸钾溶液,c到d是生成碳酸氢钾,d点是碳酸氢钾和碳酸的混合溶液,d点溶液呈中性,
A.a点溶液中的溶质是KaOH,氢氧化钾抑制了水的电离,溶液中氢离子是水电离的,则水电离出的c(H+)=10-pH=1×10-12mol•L-1,故A正确;
B.b点是强碱溶液对水的电离起抑制作用,所以溶液中的c(H+)<1×10-7mol/L,故B错误;
C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钾溶液,根据碳酸钾溶液中的物料守恒可得:c(K+)=2[c(CO32-)+c(HCO3)+c(H2CO3)],故C正确;
D.d点溶液中水电离出的OH-离子浓度10-7mol/L,溶液呈中性,c(H+)=c(OH-),结合电荷守恒c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),两式相减得:c(K+)=2c(CO32-)+c(HCO3-),故D正确;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,结合电荷守恒进行解答,注意计算碱性溶液中水电离出氢离子和氢氧根离子的方法.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 25.5g | B. | 39g | C. | 51g | D. | 106.5g |
| A. | 5%蔗糖溶液 | B. | 75%乙醇溶液 | ||
| C. | 0.5mol/LNaCl溶液 | D. | 1mol/LNaCl溶液 |
| A. | 65:(A-65) | B. | 64:(A-65) | C. | 65:(A-64) | D. | 64:(A-64) |
| A. | 量筒 | B. | 玻璃棒 | C. | 三角漏斗 | D. | 容量瓶 |
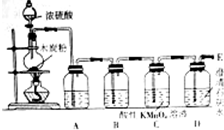 在100mL 18.4mol•L-1浓硫酸中加入1.2g木炭粉,加热使之充分反应.并按如图的装置图进行实验,依次检验反应得到的产物,请回答下列问题:
在100mL 18.4mol•L-1浓硫酸中加入1.2g木炭粉,加热使之充分反应.并按如图的装置图进行实验,依次检验反应得到的产物,请回答下列问题: