题目内容
19.配平下反应,并用单线桥表示出该反应的电子转移:2KMnO4+16HCl→2MnCl2+2KCl+5Cl2↑+8H2O
该反应中氧化剂是KMnO4,还原剂是HCl,被氧化的元素是-1价的氯元素,氧化剂与还原剂的物质的量之比为1:5若生成标准状况下2.24升氯气,则有0.2摩尔电子被转移.
分析 反应中KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,HCl→Cl2↑,Cl元素化合价由-1价升高为0价,共升高2价,化合价升降最小公倍数为10,据此结合原子守恒配平,标出电子转移情况,并结合反应计算.
解答 解:反应中KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,HCl→Cl2↑,Cl元素化合价由-1价升高为0价,共升高2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,结合原子守恒配平后方程式为2KMnO4+16 HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,反应中转移电子数目为10,标出电子转移情况为: ,氧化剂为KMnO4,还原剂为HCl,被氧化的元素是-1价的氯元素,氧化剂与还原剂的物质的量之比为2:10=1:5,若生成标准状况下2.24升氯气,则有$\frac{2.24L}{22.4L/mol}$×2×(1-0)=0.2摩尔电子被转移.
,氧化剂为KMnO4,还原剂为HCl,被氧化的元素是-1价的氯元素,氧化剂与还原剂的物质的量之比为2:10=1:5,若生成标准状况下2.24升氯气,则有$\frac{2.24L}{22.4L/mol}$×2×(1-0)=0.2摩尔电子被转移.
故答案为:2;16;2;2;5;8; ;KMnO4;HCl;-1价的氯元素;1:5;0.2.
;KMnO4;HCl;-1价的氯元素;1:5;0.2.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意转移电子的计算,题目难度不大.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | C2H6与C3H8没有同分异构体,CH2O2与C2H4O2属于同系物 | |
| B. | 一定条件下,乙酸乙酯、淀粉、蛋白质、乙烯都能与水发生水解反应 | |
| C. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g | |
| D. | 全降解塑料(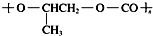 )可由单体环氧丙烷( )可由单体环氧丙烷(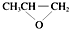 )和CO2缩聚制得 )和CO2缩聚制得 |
14.粗盐提纯时不需用到的玻璃仪器是( )
| A. | 量筒 | B. | 玻璃棒 | C. | 三角漏斗 | D. | 容量瓶 |
4.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
下列说法或表达中,正确的是( )
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | 少量二氧化碳通入NaClO溶液中:2NaClO+CO2+H2O→Na2CO3+2HClO | |
| B. | 过量的 HCN滴入碳酸钠溶液中 HCN+Na2CO3→NaCN+NaHCO3 | |
| C. | 结合质子能力由强到弱的顺序为:HCO3->CN->C6H5O- | |
| D. | 常温下电离常数:Ka2(H2CO3)>Ka(C6H5OH)>Ka (HCN) |
8.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | ||
| C. | 盐酸与氢氧化钠中和 | D. | 氧化钙溶于水 |
9.元素及其化合物丰富了物质世界,下列说法不正确的是( )
| A. | 除去FeCl2溶液中的FeCl3,可向溶液中加入足量铁粉,反应后过滤 | |
| B. | NaOH溶液和AlCl3溶液相互滴加的现象不同 | |
| C. | 用热的纯碱溶液洗碗可去除油污 | |
| D. | 将浓硫酸滴到白纸上,白纸变黑了,说明浓硫酸具有吸水性 |
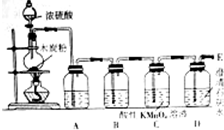 在100mL 18.4mol•L-1浓硫酸中加入1.2g木炭粉,加热使之充分反应.并按如图的装置图进行实验,依次检验反应得到的产物,请回答下列问题:
在100mL 18.4mol•L-1浓硫酸中加入1.2g木炭粉,加热使之充分反应.并按如图的装置图进行实验,依次检验反应得到的产物,请回答下列问题: