题目内容
18.下列化学用语正确的是( )| A. | CH2F2的电子式: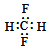 | |
| B. | CH2=CH-CH2=CH2的系统命名为:1,3-二丁烯 | |
| C. | 制漂白粉的化学原理:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| D. | 制备氢氧化铁胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ |
分析 A.缺少F的最外层电子;
B.应为1,3-丁二烯;
C.工业用氯气和石灰乳反应制备漂白粉;
D.生成的胶体不沉淀.
解答 解:A.缺少F的最外层电子,电子式为 ,故A错误;
,故A错误;
B.CH2=CH-CH2=CH2的系统命名应为1,3-丁二烯,故B错误;
C.工业用氯气和石灰乳反应制备漂白粉,方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,故C正确;
D.制备氢氧化铁胶体为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3+3H+,生成的胶体不沉淀,故D错误.
故选C.
点评 本题考查较为综合,涉及电子式、有机物的命名、石灰乳的工业制备以及胶体的制备等知识,为高考常见题型,侧重考查学生的双基知识,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
8.短周期主族元素X、Y、Z、W、M的原子序数依次增大,其中X与其它元素均不位于同一主族,Y和W的原子序数相差8,Y、Z、W三种原子的最外层电子数之和为16,X、Z的最高正价和最低负价的代数和均为0.下列说法正确的是( )
| A. | M的氢化物的水溶液能与W的钠盐溶液,反应得到W的氢化物,说明非金属性M>W | |
| B. | X和Y形成的原子个数比为1:1的分子中极性键和非极性键之比为2:1 | |
| C. | Z元素在自然界中存在游离态 | |
| D. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) |
9.下列说祛正确的是( )
| A. | 葡萄糖溶液能产生丁达尔效应 | B. | 福尔马林可用于食品的防腐保鲜 | ||
| C. | 医用酒精可用于饮用水消毒 | D. | 淀粉、油脂、蛋白质可提供营养 |
6.根据图回答,下列说法错误的是( )
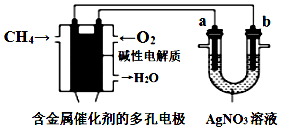

| A. | 电子经导线流入b电极 | |
| B. | 若b极增重5.4 g时,燃料电池负极消耗CH4的体积为140 mL | |
| C. | 燃料电池中正极反应为O2+4e-+2H2O═4OH- | |
| D. | 此装置用于电镀银时,一段时间后硝酸银溶液的浓度不变 |
13.W、X、Y、Z四种短周期元素,原子序数依次增大.W、Z最外层电子数相同,Z的核电荷数是W的2倍,X的焰色反应呈黄色,工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是( )
| A. | 原子半径:X>Y>Z>W | |
| B. | X、Y和Z三种元素的最高价氧化物的水化物两两之间能相互反应 | |
| C. | X和Y对应的氯化物都是离子晶体 | |
| D. | W的最简单氢化物沸点比Z的高 |
3.化学与生产、生活息息相关,下列有关说法正确的是( )
| A. | Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| B. | 为防止食品氧化,常在食品袋中放入装有CaO的透气小袋 | |
| C. | 油脂在人体内水解为氨基酸和甘油等小分子被吸收 | |
| D. | 生产有机玻璃的主要原料为纯碱、石英和石灰石 |
1.运用化学反应原理研究碳、氮、硫元素及其化合物有重要意义.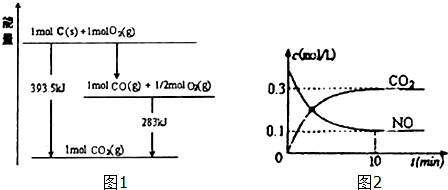
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:
写出CO2(g)与C(s)反应生成CO(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(2)汽车尾气净化过程中发生反应2NO(g)+2CO(g)?N2+2CO2(g)△H<0.一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L,(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图2所示曲线.
①下列关于上述反应过程的叙述正确的是AD(填写字母代号).
A.其它条件不变,加入催化剂,△H的值不变
B.及时除去二氧化碳,反应的正反应速率加快
C.NO、CO、N2、CO2浓度均不再变化,说明未达到平衡状态
D.混合气体的平均相对分子质量不再改变,证明反应达到化学平衡状态
②前10min内CO的平均反应速率为0.03mol/(L•min),达平衡时NO的转化率为75%,能使上述平衡体系中$\frac{n(C{O}_{2})}{n(NO)}$增大的措施有降低温度或加压或增大CO的物质的量或从体系中分离出N2(任写一条).
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表(单位省略):
①室温条件下.用敞口容器加热氨水一段时间,恢复至室温后,溶液中水的电离程度比加热前增大(填写“增大”、“减小”或“不变”).
②常温下,测得某碳酸饮料的pH=6,则该饮料$\frac{n(C{O}_{3}^{2-})}{n(HC{O}_{3}^{-})}$=5.6×10-5.

(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:
写出CO2(g)与C(s)反应生成CO(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(2)汽车尾气净化过程中发生反应2NO(g)+2CO(g)?N2+2CO2(g)△H<0.一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L,(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图2所示曲线.
①下列关于上述反应过程的叙述正确的是AD(填写字母代号).
A.其它条件不变,加入催化剂,△H的值不变
B.及时除去二氧化碳,反应的正反应速率加快
C.NO、CO、N2、CO2浓度均不再变化,说明未达到平衡状态
D.混合气体的平均相对分子质量不再改变,证明反应达到化学平衡状态
②前10min内CO的平均反应速率为0.03mol/(L•min),达平衡时NO的转化率为75%,能使上述平衡体系中$\frac{n(C{O}_{2})}{n(NO)}$增大的措施有降低温度或加压或增大CO的物质的量或从体系中分离出N2(任写一条).
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表(单位省略):
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 1.7×10-5 |
②常温下,测得某碳酸饮料的pH=6,则该饮料$\frac{n(C{O}_{3}^{2-})}{n(HC{O}_{3}^{-})}$=5.6×10-5.
2.全氮类物质具有高密度、超高能量及爆轰产物无污染等优点.中国科学家成功合成全氮阴离子N5-,N5-是制备全氮类物质N5+N5-的重要中间体.下列说法中,不正确的是( )
| A. | 全氮类物质属于绿色能源 | B. | 每个N5+中含有35个质子 | ||
| C. | 每个N5-中含有35个电子 | D. | N5+N5-结构中含共价键 |
 .
.