题目内容
2.全氮类物质具有高密度、超高能量及爆轰产物无污染等优点.中国科学家成功合成全氮阴离子N5-,N5-是制备全氮类物质N5+N5-的重要中间体.下列说法中,不正确的是( )| A. | 全氮类物质属于绿色能源 | B. | 每个N5+中含有35个质子 | ||
| C. | 每个N5-中含有35个电子 | D. | N5+N5-结构中含共价键 |
分析 A、全氮类物质爆轰产物无污染等优点;
B、每个N5+中含有质子为7×5=35个;
C、电子为35+1=36个电子;
D、N5+和N5-离子间存在离子键,而离子内氮氮之间存在共价键;
解答 解:A、全氮类物质爆轰产物无污染等优点,所以属于绿色能源,故A正确;
B、每个N5+中含有质子为7×5=35个,而电子为35-1=34个电子,故B正确;
C、电子为35+1=36个电子,所以每个N5-中含有36个电子,故C错误;
D、N5+和N5-离子间存在离子键,而离子内氮氮之间存在共价键,所以N5+N5-结构中含共价键,故D正确;
故选C.
点评 主要考查了原子的构成和原子和离子之间的相互转化,离子是由于质子和电子的数目相不等而带电,化学键的类型,比较容易.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目
18.下列化学用语正确的是( )
| A. | CH2F2的电子式: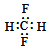 | |
| B. | CH2=CH-CH2=CH2的系统命名为:1,3-二丁烯 | |
| C. | 制漂白粉的化学原理:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| D. | 制备氢氧化铁胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ |
13.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同),原子结构示意图为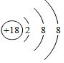 .元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
.元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是: .
.
(3)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(4)元素①与⑦形成的化合物的电子式 ,
,
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->K+.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
.元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)元素①与⑦形成的化合物的电子式
 ,
,(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->K+.
10.已知氢化锂(LiH)属于离子化合物,LiH跟水反应可以放出氢气.下列叙述中正确的是( )
| A. | LiH跟水反应后的溶液显中性 | B. | LiH在化学反应中是一种强氧化剂 | ||
| C. | LiH中氢离子可以被还原成氢气 | D. | LiH中氢离子半径比锂离子半径大 |
17.向20.0gCu 和Cu2S的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成S单质、Cu(NO3)2和标准状况下4.48LNO.过滤后向所得溶液中加入1.0mol/L的NaOH溶液1.0L,金属离子完全沉淀,此时溶液呈中性.下列有关说法不正确的是( )
| A. | Cu与Cu2S的物质的量之比为10:1 | |
| B. | 硝酸的物质的量浓度为1.2mol/L | |
| C. | Cu(OH)2沉淀质量为29.4g | |
| D. | Cu、CuS与硝酸反应后剩余HNO3为0.4mol |
7.化学与生活密切相关,下列说法错误的是( )
| A. | 人工分子筛(多孔硅铝酸盐)可以用作吸附剂和催化剂 | |
| B. | 硅胶可以用作食品、药品的干燥剂 | |
| C. | 利用风能、太阳能等能源代替化石燃料,有利于节约能源保护环境 | |
| D. | 蚕丝、腈纶和涤纶既属于化学纤维又属于高分子化合物 |
14.分子式为C9H12的芳香烃共有(不含之体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
11.某有机物A,其分子式为C5H10O2.已知1mol A与足量的钠反应可生成标况下22.4L的H2,A不能使溴的CCl4溶液褪色,其分子结构中无甲基,且同一个碳原子上只连有一个官能团,符合以上条件的A的同分异构体有( )
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
13.常温下,有下列四种溶液:下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1mol/LNaOH溶液 | pH=11NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的PH>5 | |
| C. | ①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH) | |
| D. | 等体积等PH的④溶液和盐酸分别与足量的Zn反应,④溶液生成同条件下氢气体积多 |