题目内容
9.下列说祛正确的是( )| A. | 葡萄糖溶液能产生丁达尔效应 | B. | 福尔马林可用于食品的防腐保鲜 | ||
| C. | 医用酒精可用于饮用水消毒 | D. | 淀粉、油脂、蛋白质可提供营养 |
分析 A.丁达尔效应是胶体特有的性质;
B.福尔马林为甲醛水溶液,甲醛有毒;
C.医用洒精能够使蛋白质变性,具有杀菌作用;
D.淀粉、蛋白质、油脂都是营养物质.
解答 解:A.葡萄糖溶液不是胶体,不具有丁达尔效应,故A错误;
B.福尔马林为甲醛水溶液,甲醛有毒,不能用于食品防腐,故B错误;
C.医用酒精能够使蛋白质变性,具有杀菌作用,但是不用于饮用水消毒,故C错误;
D.淀粉、蛋白质、油脂都是营养物质,能够提高人体需要的营养,故D正确;
故选:D.
点评 本题为综合题,涉及胶体、甲醛、医用酒精、营养均衡和人体健康,明确相关物质的性质是解题关键,题目难度不大,注意相关知识的积累.

练习册系列答案
相关题目
20.下列溶液一定呈中性的是( )
| A. | PH=7的溶液 | |
| B. | 非电解质溶于水得到的溶液 | |
| C. | 由强酸和强碱等物质的量反应得到的物质 | |
| D. | c (H+)=c (OH-) |
4.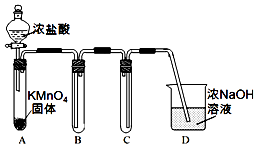 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
I.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用如图装置及试剂制备并收集适量Cl2,装置B中收集的气体中所含的杂质有HCl、H2O(g),D的作用是吸收C中逸出的Cl2.
(2)制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有Cl-、Cl2、ClO-、HClO(写出全部微粒的化学式).
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一.在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强.
①滤液漂白性增强的原因是氯水中存在平衡Cl2+H2O?H++Cl-+HClO,CaCO3与盐酸反应,平衡正向移动,增大了HClO的浓度,漂白效果增强(用化学平衡移动原理解释).
②已知H2CO3的第二电离常数K2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出Cl2与Na2CO3溶液按物质的量之比1:1恰好反应的离子方程式Cl2+H2O+CO32-=HCO3-+HClO+Cl-.
Ⅱ.ClO3-、Cl-和H+反应的探究
(4)KClO3、KCl与硫酸可以反应.该小组设计了系列实验研究反应条件对反应的影响,实验记录如表(实验在室温下进行):
①该系列实验的目的其他条件相同,氢离子或者硫酸浓度不同对化学反应速率的影响.
②烧杯2加水的体积V4应为6 mL,烧杯4中的现象溶液呈黄绿色,生成黄绿色气体.
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化.
 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.I.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用如图装置及试剂制备并收集适量Cl2,装置B中收集的气体中所含的杂质有HCl、H2O(g),D的作用是吸收C中逸出的Cl2.
(2)制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有Cl-、Cl2、ClO-、HClO(写出全部微粒的化学式).
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一.在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强.
①滤液漂白性增强的原因是氯水中存在平衡Cl2+H2O?H++Cl-+HClO,CaCO3与盐酸反应,平衡正向移动,增大了HClO的浓度,漂白效果增强(用化学平衡移动原理解释).
②已知H2CO3的第二电离常数K2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出Cl2与Na2CO3溶液按物质的量之比1:1恰好反应的离子方程式Cl2+H2O+CO32-=HCO3-+HClO+Cl-.
Ⅱ.ClO3-、Cl-和H+反应的探究
(4)KClO3、KCl与硫酸可以反应.该小组设计了系列实验研究反应条件对反应的影响,实验记录如表(实验在室温下进行):
| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | V1mL | V2mL | V3mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | V4mL | 3mL | 0mL |
| 硫酸(6mol/L) | V5mL | 2mL | V6mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 |
②烧杯2加水的体积V4应为6 mL,烧杯4中的现象溶液呈黄绿色,生成黄绿色气体.
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化.
14.镁锰干电池中反应的化学方程式为Mg+2MnO2+H2O═Mg (OH)2+Mn2O3.下列说法正确的是( )
| A. | 负极的电极反应式为Mg+2OH-+2e-═Mg(OH)2 | |
| B. | 电池放电时,OH-向负极移动 | |
| C. | 电解质溶液可以是稀H2SO4 | |
| D. | 正极的电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH- |
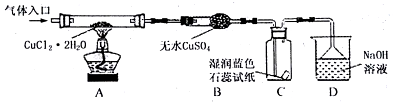
1.CuCl广泛应用于化工和印染等行业.某研究性学习小组拟热分解ag CuCl2•2H2O制备CuCl,该小组用如图所示装置进行实验(夹持仪器略),并开展相关探究.
阅读资料:
请回答下列问题:
(1)请在表中填写实验操作的步骤.
(2)在实验过程中观察到B中物质由白色变为蓝色,C中试纸的颜色变化是先变红后褪色.
(3)装置D的作用是收尾气氯气和氯化氢:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析其原因:
①若杂质是CuCl2,则产生的原因是加热温度不够.
②若杂质是CuO,则产生的原因是HCl气流不足.
(5)在不了解CuCl化学性质的前提下,如何证明实验得到的CuCl样品中含有CuCl2杂质对反应后得到的产品进行称量,求出agCuCl2•2H2O完全转化为CuCl的质量,如果该数值小于产品的称量值,就可判断含有氯化铜.

阅读资料:
| 资料一 | CuCl2•2H2O | 在HCl气流中加热至140℃ | 产生CuCl2 | CuCl2在受热大于300℃时 | 生成CuCl和Cl2 |
| 资料二 | CuCl2•2H2O | 直接加热 | 产生Cu2(OH)2Cl2 | Cu2(OH)2Cl2在受热到200℃时 | 产生CuO |
(1)请在表中填写实验操作的步骤.
| 步骤 | 操作描述 |
| ① | 检验装置的气密性后加药品 |
| ② | 在“气体入口”处通干燥HCl |
| ③ | 点燃酒精灯,加热 |
| ④ | 熄灭酒精灯,冷却 |
| ⑤ | 停止通入HCl,然后通入N2 |
(3)装置D的作用是收尾气氯气和氯化氢:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析其原因:
①若杂质是CuCl2,则产生的原因是加热温度不够.
②若杂质是CuO,则产生的原因是HCl气流不足.
(5)在不了解CuCl化学性质的前提下,如何证明实验得到的CuCl样品中含有CuCl2杂质对反应后得到的产品进行称量,求出agCuCl2•2H2O完全转化为CuCl的质量,如果该数值小于产品的称量值,就可判断含有氯化铜.
18.下列化学用语正确的是( )
| A. | CH2F2的电子式: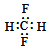 | |
| B. | CH2=CH-CH2=CH2的系统命名为:1,3-二丁烯 | |
| C. | 制漂白粉的化学原理:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| D. | 制备氢氧化铁胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ |
13.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同),原子结构示意图为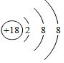 .元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
.元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是: .
.
(3)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(4)元素①与⑦形成的化合物的电子式 ,
,
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->K+.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
.元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)元素①与⑦形成的化合物的电子式
 ,
,(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->K+.
