题目内容
10.甲酸钠广泛用作催化剂、稳定合成剂和印染行业的还原剂等.工业上可用CO和NaOH反应制甲酸钠晶体,CO主要来自电石炉废气(主要成分为CO,含少量CO2、H2S、N2、CH4等),合成甲酸钠的部分工艺流程如图: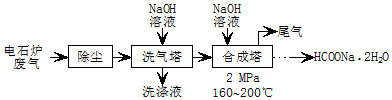
回答下列问题:
(1)惰性材料作电极,电解“洗涤液”可回收硫.阳极的电解反应式可能是S2--2e-=S↓,(x-1)S+S2-=Sx2-.
(2)尾气的主要用途有合成氨原料、作燃料等.N2的电子式为
 .
.(3)合成塔中采用逆流操作(即液体从上向下喷洒),其目的是增大气液接触面积,提高反应物转化率.合成塔中主要反应的化学方程式为CO+NaOH$\frac{\underline{\;\;\;\;\;\;\;2MPa\;\;\;\;\;\;\;}}{160~200℃}$HCOONa.
(4)从合成塔中可得到甲酸钠稀溶液,则从该溶液中提取HCOONa•2H2O晶体的主要步骤、洗涤、干燥.
(5)测定产品纯度:取m g样品溶于蒸馏水配制250mL溶液.准确量取25.00mL于锥形瓶,滴加适量稀硫酸,用c mol/L标准KMnO4溶液滴定至终点,消耗标准液V mL.滴定反应为5HCOO-+8H++1MnO4-→5CO2↑+1Mn2++4H2O(未配平)该HCOONa•2H2O产品纯度为$\frac{5.2cV}{m}×100%$(用代数式表示).
分析 电石炉废气(CO 75~90%,以及少量CO2、H2S、N2、CH4等)先除尘,然后用碱液洗涤,溶液中CO2、H2S反应生成盐,然后将气体通入合成塔,并加入NaOH溶液、加热至160-200℃、加压,最终得到HCOONa.2H2O,最后剩余N2和CH4,将尾气排空,
(1)碱液洗涤除尘后的废气,CO2、H2S被吸收,洗涤液含有Na2CO3、Na2S、NaOH,阳极为硫离子发生氧化反应;
(2)尾气为N2和CH4,据此分析;氮气分子中存在氮氮三键,氮原子最外层为8电子;据此书写即可;
(3)逆流操作可增大气液接触面积,提高反应物转化率;合成塔为CO和NaOH反应制甲酸钠;
(4)从溶液中获取溶质采用蒸发浓缩、冷却结晶、过滤再经洗涤干燥得到;
(5)根据化合价的升降变化和质量守恒可得滴定反应;根据高锰酸钾计算HCOONa•2H2O的质量,据此计算其纯度.
解答 解:(1)碱液具有碱性,能吸收酸性气体,CO2、H2S都是酸性气体,被碱液吸收,发生的反应为CO2+2NaOH=Na2CO3+H2O、H2S+2NaOH=Na2S+2H2O,洗涤液含有Na2CO3、Na2S、NaOH,阳极为硫离子发生氧化反应:反应式为:S2--2e-=S↓;
故答案为:S2--2e-=S↓;
(2)尾气为N2和CH4,氮气为合成氨原料,甲烷作燃料;氮原子最外层有5个电子,需3个达稳定结构,所以其电子式为: ;
;
故答案为:合成氨原料、作燃料等; ;
;
(3)逆流操作可增大气液接触面积,提高反应物转化率;合成塔为CO和NaOH反应制甲酸钠,反应为:CO+NaOH$\frac{\underline{\;\;\;\;\;\;\;2MPa\;\;\;\;\;\;\;}}{160~200℃}$HCOONa;
故答案为:增大气液接触面积,提高反应物转化率;CO+NaOH$\frac{\underline{\;\;\;\;\;\;\;2MPa\;\;\;\;\;\;\;}}{160~200℃}$HCOONa;
(4)从溶液中提取HCOONa•2H2O晶体的主要步骤蒸发浓缩、冷却结晶、过滤再经洗涤干燥得到;
故答案为:蒸发浓缩;冷却结晶;
(5)滴定反应为5HCOO-+8H++MnO4-=5CO2↑+Mn2++4H2O,根据5HCOONa•2H2O~5HCOO-~MnO4-,则样品中m(HCOONa•2H2O)=5×cmol/L×V×10-3L×104g/mol×$\frac{250mL}{25mL}$=5.2cVg,该HCOONa•2H2O产品纯度为$\frac{5.2cV}{m}×100%$;
故答案为:5;8;1;5;1;4;$\frac{5.2cV}{m}×100%$.
点评 本题考查物质分离和提纯,为高频考点,侧重考查离子反应、基本实验操作、氧化还原反应、纯度计算等知识点,明确反应原理及操作基本方法是解本题关键,题目难度不大.

| A. | PH=7的溶液 | |
| B. | 非电解质溶于水得到的溶液 | |
| C. | 由强酸和强碱等物质的量反应得到的物质 | |
| D. | c (H+)=c (OH-) |
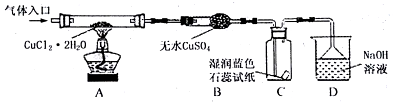
阅读资料:
| 资料一 | CuCl2•2H2O | 在HCl气流中加热至140℃ | 产生CuCl2 | CuCl2在受热大于300℃时 | 生成CuCl和Cl2 |
| 资料二 | CuCl2•2H2O | 直接加热 | 产生Cu2(OH)2Cl2 | Cu2(OH)2Cl2在受热到200℃时 | 产生CuO |
(1)请在表中填写实验操作的步骤.
| 步骤 | 操作描述 |
| ① | 检验装置的气密性后加药品 |
| ② | 在“气体入口”处通干燥HCl |
| ③ | 点燃酒精灯,加热 |
| ④ | 熄灭酒精灯,冷却 |
| ⑤ | 停止通入HCl,然后通入N2 |
(3)装置D的作用是收尾气氯气和氯化氢:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析其原因:
①若杂质是CuCl2,则产生的原因是加热温度不够.
②若杂质是CuO,则产生的原因是HCl气流不足.
(5)在不了解CuCl化学性质的前提下,如何证明实验得到的CuCl样品中含有CuCl2杂质对反应后得到的产品进行称量,求出agCuCl2•2H2O完全转化为CuCl的质量,如果该数值小于产品的称量值,就可判断含有氯化铜.
| A. | CH2F2的电子式: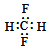 | |
| B. | CH2=CH-CH2=CH2的系统命名为:1,3-二丁烯 | |
| C. | 制漂白粉的化学原理:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| D. | 制备氢氧化铁胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ |
| 实验操作 | 相应实验现象 | 结论或推论 | |
| A | 溴水中加入苯,充分振荡、静置 | 水层几乎呈无色 | 苯与溴发生了反应 |
| B | 一小粒金属钠投入装有无水乙醇的试管中 | 反应结束前一段时间,钠浮在乙醇表面 | 密度:乙醇大于钠 |
| C | 分别向盛有KI3溶液的a、b试管中滴加淀粉溶液和AgNO3溶液 | a中溶液变蓝,b中产生黄色沉淀 | KI3溶液中存在:I3-?I2+I- |
| D | 分别向含Mn2+的草酸溶液X和不含Mn2+的草酸溶液Y中滴加酸性高锰酸钾溶液 | 高锰酸钾溶液在X溶液中褪色较快 | Mn2+也能还原高锰酸钾 |
| A. | A | B. | B | C. | C | D. | D |
| A. | HF、HCl、HBr、HI的稳定性逐渐减弱 | |
| B. | C、N、O、F的最高正化合价逐渐增大 | |
| C. | KOH、NaOH、Mg(OH)2、Al(OH)3的碱性逐渐减弱 | |
| D. | SiH4、PH3、H2S、HCl的还原性逐渐减弱 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
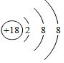 .元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
.元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)元素①与⑦形成的化合物的电子式
 ,
,(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->K+.
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |