题目内容
1.运用化学反应原理研究碳、氮、硫元素及其化合物有重要意义.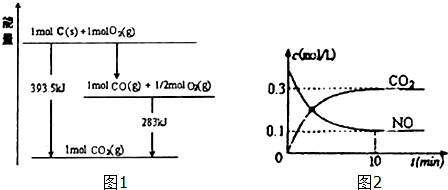
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:
写出CO2(g)与C(s)反应生成CO(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(2)汽车尾气净化过程中发生反应2NO(g)+2CO(g)?N2+2CO2(g)△H<0.一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L,(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图2所示曲线.
①下列关于上述反应过程的叙述正确的是AD(填写字母代号).
A.其它条件不变,加入催化剂,△H的值不变
B.及时除去二氧化碳,反应的正反应速率加快
C.NO、CO、N2、CO2浓度均不再变化,说明未达到平衡状态
D.混合气体的平均相对分子质量不再改变,证明反应达到化学平衡状态
②前10min内CO的平均反应速率为0.03mol/(L•min),达平衡时NO的转化率为75%,能使上述平衡体系中$\frac{n(C{O}_{2})}{n(NO)}$增大的措施有降低温度或加压或增大CO的物质的量或从体系中分离出N2(任写一条).
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表(单位省略):
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 1.7×10-5 |
②常温下,测得某碳酸饮料的pH=6,则该饮料$\frac{n(C{O}_{3}^{2-})}{n(HC{O}_{3}^{-})}$=5.6×10-5.
分析 (1)根据图象写出生成一氧化碳和二氧化碳的热化学方程式,再根据盖斯定律计算二氧化碳转化为一氧化碳的热化学方程式;
(2)①A、催化剂改变反应速率不改变化学平衡;
B.正反应速率由反应物的浓度决定;
C.当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变;
D.选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
②发生反应:2NO+2CO=N2+2CO2,计算消耗CO物质的量浓度,根据v=$\frac{△c}{△t}$计算v(CO),根据图象中二氧化碳生成浓度计算得到一氧化氮消耗浓度,得到NO起始浓度,而计算NO转化率;反应为气体体积减小的放热反应,结合平衡移动原理分析平衡正向进行的条件;
(3)①室温条件下.用敞口容器加热氨水一段时间,一水合氨分解生成的氨气挥出,恢复至室温后,导致一水合氨溶液浓度减小,对水电离程度有限减小;
②常温下,测得某碳酸饮料的pH=6,$\frac{n(C{{O}_{3}}^{2-})}{n(HC{{O}_{3}}^{-})}$=$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$=$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{{K}_{2}}{c({H}^{+})}$;
解答 解:(1)由图可知,1molC(s)与0.5molO2(g)反应得到1molCO(g)放出热量=393.5kJ-283kJ=110.5kJ,该反应热化学方程式为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol ①
1molC(s)与1molO2(g)反应得到1molCO2(g)放出热量393.5kJ,该反应热化学方程式为:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②
根据盖斯定律,①×2-②得:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol;
故答案为:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol;
(2)①A、催化剂不影响平衡移动,所以,加入催化剂△H不变,故A正确;
B.除去二氧化碳,生成物浓度降低,平衡正向移动,正反应速率逐渐减慢,故B错误;
C.NO、CO、N2、CO2浓度均不再变化,说明达到平衡状态,故C正确;
D.混合气体的平均相对分子质量M=$\frac{m}{n}$,质量在反应前后是守恒的,是一个反应前后物质的量会变化的反应,所以当M不变时,达到了平衡,故D正确;
故选:AD;
②一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L,(标准状况)NO和CO混合气体物质的量为=$\frac{44.8L}{22.4L/mol}$=2mol,NO物质的量为1mol,CO物质的量为1mol,发生反应:2NO+2CO=N2+2CO2,平衡时CO2物质的量浓度0.3mol/L,则消耗CO是0.3mol/L,v(CO)=$\frac{0.3mol/L}{10min}$=0.03mol/(L•min),NO反应的浓度为0.3mol/L,平衡状态下NO浓度为0.1mol/L,则原来NO浓度为0.4mol/L,则NO转化率=$\frac{0.3mol/L}{0.4mol/L}$×100%=75%,
能使上述平衡体系中$\frac{n(C{O}_{2})}{n(NO)}$增大的措施是平衡正向进行,2NO(g)+2CO(g)?N2+2CO2(g)△H<0,反应为放热反应,降低温度,增大压强或增加CO量或从体系中分离出N2 都可以使平衡正向进行,平衡体系中$\frac{n(C{O}_{2})}{n(NO)}$增大,
故答案为:0.03mol/(L•min),75%,降低温度,加压,增大CO的物质的量,从体系中分离出N2;
(3)①室温条件下.用敞口容器加热氨水一段时间,一水合氨分解生成的氨气挥出,恢复至室温后,导致一水合氨溶液浓度减小,对水电离程度有限减小,恢复至室温后,溶液中水的电离程度比加热前增大,
故答案为:增大;
②常温下,测得某碳酸饮料的pH=6,$\frac{n(C{{O}_{3}}^{2-})}{n(HC{{O}_{3}}^{-})}$=$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$=$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{{K}_{2}}{c({H}^{+})}$=$\frac{5.6×1{0}^{-11}}{1{0}^{-6}}$=5.6×10-5,
故答案为:5.6×10-5.
点评 本题考查了热化学方程式书写、有限化学平衡因素、化学平衡移动原理的理解、平衡三行计算方法、弱电解质电离平衡常数等,掌握基础是解题关键,题目难度中等.

| A. | CH2F2的电子式: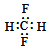 | |
| B. | CH2=CH-CH2=CH2的系统命名为:1,3-二丁烯 | |
| C. | 制漂白粉的化学原理:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| D. | 制备氢氧化铁胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ |
| A. | HF、HCl、HBr、HI的稳定性逐渐减弱 | |
| B. | C、N、O、F的最高正化合价逐渐增大 | |
| C. | KOH、NaOH、Mg(OH)2、Al(OH)3的碱性逐渐减弱 | |
| D. | SiH4、PH3、H2S、HCl的还原性逐渐减弱 |
| A. | 1molFeCl3跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为NA | |
| B. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| C. | 6.8克熔融的KHSO4中含有0.1NA个阳离子 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
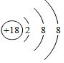 .元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
.元素⑤名称为Al在周期表中的位置第三周期ⅢA族.元素④与元素⑤最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)元素①与⑦形成的化合物的电子式
 ,
,(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->K+.
| A. | LiH跟水反应后的溶液显中性 | B. | LiH在化学反应中是一种强氧化剂 | ||
| C. | LiH中氢离子可以被还原成氢气 | D. | LiH中氢离子半径比锂离子半径大 |