题目内容
2.将Cu与CuO的混合物20.8g加到50mL 18.4mol•L-1浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得c(Cu2+)=0.3mol•L-1.试计算:(1)反应过程中放出的气体在标准状况下的体积.
(2)溶解稀释后,氢离子的浓度.
分析 (1)分别设出Cu与CuO的物质的量,根据质量为20.8g和反应后c(Cu2+)=0.3mol/L列方程组解得Cu与CuO的物质的量,Cu与浓硫酸反应放出气体,根据反应计算即可;
(2)用硫酸中氢离子的总量减去被Cu与CuO消耗掉的,即可求算出稀释后c(H+).
解答 解:设混合物中Cu的物质的量为x,CuO的物质的量为y,
根据混合物为20.8g可有:64x+80y=20.8…①
根据混合液稀释至1000mL,c(Cu2+)=0.3mol/L,可有:x+y=0.3…②
解①②得:x=0.2mol、y=0.1mol,
(1)Cu与浓硫酸反应放出SO2气体,设生成气体的物质的量为amol,根据反应:
Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
1 1
0.2mol amol
可得:$\frac{1}{0.2}$=$\frac{1}{a}$,
解得:a=0.2mol.
标况下0.2mol二氧化硫的体积为:V=22.4L/mol×0.2mol=4.48L,
答:反应过程中放出的气体在标准状况下的体积为4.48L;
(2)已知n(H2SO4)总=0.05L×18.4mol/L=0.92mol
n(H2SO4)反应=2x+y=0.5mol
n(H2SO4)余=0.92mol-0.5mol=0.42mol
故 c(H +)=0.42mol×2÷1L=0.84mol/L
答:溶解稀释后,氢离子的浓度为0.84mol/L.
点评 本题考查了物质的量浓度的相关计算,题目难度不大,掌握公式的使用是解题的关键,试题培养了学生的化学计算能力.

| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出 | |
| C. | 制备乙酸乙酯时,为除去乙酸乙酯中的乙酸,用饱和碳酸钠溶液收集产物 | |
| D. | 制乙烯时,用量程为100℃的温度计代替量程为300℃的温度计,测反应液的温度 |
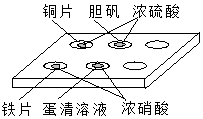 在如图所示的实验中,对点滴板上的现象描述正确的是( )
在如图所示的实验中,对点滴板上的现象描述正确的是( )①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有铁片的孔穴中溶液呈浅黄色
⑤装有蛋清溶液的孔穴中呈浅黄色.
| A. | ①④ | B. | ②③ | C. | ①⑤ | D. | ②⑤ |
| A | B | C | D |
| 钢闸门容易被腐蚀 | a、b均为惰性电极,b极反应是:O+4OH--4e-=2H2O | 阴、阳两极生成的气体的物质的量之比是1:1 | 电池工作一段时间 后,乙池溶液的总质量增加 |
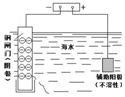 | 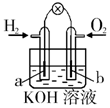 | 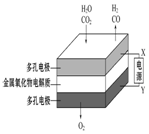 | 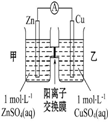 |
| A. | A | B. | B | C. | C | D. | D |
| A. | “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高 | |
| B. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| C. | “爆竹声中除旧岁,春风送暖入屠苏”爆竹爆炸发生的是分解反应 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
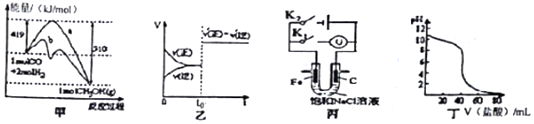
| A. | 图甲表示工业上用CO生成甲醇的反应CO(g)+2H2(g)?CH2OH(g),该反应的△H=-91kJ•mol-1 | |
| B. | 图乙表示已达到平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是加入催化剂 | |
| C. | 图丙中若K1闭合,石墨棒周围溶液pH逐渐升高;若K2闭合,电路中通过0.002NA个电子时,两极理论上共产生0.002mol气体 | |
| D. | 图丁表示盐酸滴加0.1 mol•L-1NaOH溶液的得到的滴定曲线,该实验的指示剂最好选取酚酞 |
| A. | 食物腐败 | B. | 氨气液化 | C. | 海水晒盐 | D. | 石油分馏 |