题目内容
14.古代的很多成语、谚语都蕴含着很多科学知识,下列对成语、谚语的解释正确的是( )| A. | “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高 | |
| B. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| C. | “爆竹声中除旧岁,春风送暖入屠苏”爆竹爆炸发生的是分解反应 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
分析 A.冰转化为水的过程吸热;
B.有新物质生成的变化为化学变化;
C.“爆竹声中除旧岁,春风送暖入屠苏”是炸药的爆炸;
D.焰色反应为某些金属元素的性质.
解答 解:A.冰转化为水的过程吸热,因此相同质量和温度的水和冰,水的能量高,故A错误;
B..“玉不琢不成器”只是玉的形状改变,是物理变化,故B错误;
C.“爆竹声中除旧岁,春风送暖入屠苏”是炸药的爆炸,S+2KNO3+3C═K2S+N2↑+3CO2↑,不属于分解反应,故C错误;
D.焰色反应为元素的性质,则节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩,故D正确;
故选:D.
点评 本题考查物质变化、焰色反应等知识,平时必须注重知识的积累,才能正确解答本类题型,注重化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
4.下列表示对应化学反应的离子方程式正确的是( )
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 过量的SO2通入NaOH溶液中:SO2-+2OH-=SO32-+H2O | |
| D. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
5.下列除去杂质的方法正确的是( )
| A. | 除去乙烷中少量的乙烯:气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤、分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰、蒸馏 |
9.有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
| 实验步骤 | 解释或实验结论 |
| (1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为:C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)该有机物分子中含有羟基、羧 基各1mol,羟基的电子式为 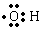 . . |
(4)A的核磁共振氢谱如图: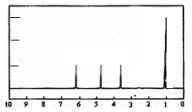 | (4)A中含有4种氢原子. |
(5)综上所述,A的结构简式 , , | |
19. 亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:
①2NO+Na2O2═2NaNO2
②2NO2+Na2O2═2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-被还原成Mn2+.
Ⅰ.产品制备与检验:用如图装置制备NaNO2
(1)写出装置A烧瓶中发生反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)B装置的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO);盛浓硝酸的仪器名称为分液漏斗.
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净的NaNO2,应在B、C装置间增加一个干燥管.在干燥管中盛放的试剂名称为碱石灰.
(4)请设计实验,检验装置C中NaNO2的存在(写出操作、现象和结论)取少量装置C中产物置于试管中,加入适量蒸馏水溶解,滴加少量酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2.
Ⅱ.含量的测定
称取装置C中反应后的固体4.00g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如表所示:
(5)第一组实验数据出现异常,造成这种异常的原因可能是A、C.
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定结束后仰视读数
D.滴定结束后俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%或0.8625.
 亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:①2NO+Na2O2═2NaNO2
②2NO2+Na2O2═2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-被还原成Mn2+.
Ⅰ.产品制备与检验:用如图装置制备NaNO2
(1)写出装置A烧瓶中发生反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)B装置的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO);盛浓硝酸的仪器名称为分液漏斗.
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净的NaNO2,应在B、C装置间增加一个干燥管.在干燥管中盛放的试剂名称为碱石灰.
(4)请设计实验,检验装置C中NaNO2的存在(写出操作、现象和结论)取少量装置C中产物置于试管中,加入适量蒸馏水溶解,滴加少量酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2.
Ⅱ.含量的测定
称取装置C中反应后的固体4.00g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定结束后仰视读数
D.滴定结束后俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%或0.8625.
6. 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )| A. | 原氨水浓度x=0.01mol•L-1 | |
| B. | m、p两点溶液中由水电离出来的c(OH-):m>p | |
| C. | n点溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 若在m点溶液中加少量水,[c(NH3•H2O)•c(H+)]/c(NH4+)不变 |