题目内容
12.高纯度的单晶硅生产方法主要为:SiO2$→_{①}^{焦炭}$粗硅$→_{②}^{HClCl_{2}}$$\stackrel{SiHC{l}_{3}}{(沸点31.5℃)}$$→_{③}^{H_{2}高温}$Si(纯)$→_{④}^{气相沉积法}$$\stackrel{超纯硅}{(多晶硅)}$$\stackrel{⑤}{→}$单晶硅
制得的粗硅中含有的杂质主要为C、SiO2(写化学式)
请分别写出上述流程中①、③的化学方程式:①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑ ③SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl.
分析 用碳在高温下还原二氧化硅可制得含少量杂质的粗硅,信息产业的核心材料是高纯度单晶硅,将粗硅用HCl、Cl2处理转化为沸点低的SiHCl3,通过蒸馏极易分离提纯,然后将纯的SiHCl3在高温下用H2还原即可得到纯度高的Si,据此解答.
解答 解:根据生产流程,可得反应①反应式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑,所得的粗硅中含有大量的其它杂质(如C、SiO2等),没有实际应用价值,将粗硅用HCl、Cl2处理转化为沸点低的SiHCl3,反应方程式为Si+Cl2+HCl$\frac{\underline{\;高温\;}}{\;}$SiHCl3,低沸点的SiHCl3通过蒸馏极易分离提纯,然后将纯的SiHCl3在高温下用H2还原即可得到纯度高的Si蒸气:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl,再进行气相沉淀即可制得高纯度的硅,从而得到单晶硅,
故答案为:C、SiO2;SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑;SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl.
点评 本题考查了硅的有关知识,掌握硅及其化合物的性质是解题的关键,题目难度中等.

练习册系列答案
相关题目
3.W、X、Y、Z分别为原子序数递增的短周期元素,X、Y的阳离子与Ne具有相同的电子层结构,且其单质均可与水反应,生成W的单质;Z的单质为黄绿色气体.下列说法正确的是( )
| A. | W与X形成的简单二元化合物的电子式为 | |
| B. | 短周期元素中Y的原子半径最大 | |
| C. | 工业上通过电解Y的氧化物制取Y的单质 | |
| D. | 最外层电子数等于其电子层数的金属与Z形成离子化合物 |
4.下列说法正确的是( )
| A. | BaCl2溶液中通入足量的SO2气体后,所得溶液中2c(Ba2+)═c(Cl-) | |
| B. | 某溶液由水电离的c(H+)=1×10-amol/L,若a>7,则该溶液的pH一定为14-a | |
| C. | 物质的量浓度相等的H2S和NaHS混合溶液:c(Na+)═2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 常温下,若0.1mol/L NaHY溶液的pH=4,则该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(H2Y)>c(Y2-) |
1.下列说法正确的是( )
| A. | 蔗糖与纤维素均属于高分子化合物 | |
| B. | 不同的油脂发生皂化反应,至少有一种产物相同 | |
| C. | 淀粉在稀硫酸作用下充分加热后,所得溶液与少量新制Cu(OH)2共热未见红色沉淀,说明淀粉未发生水解 | |
| D. | 蛋白质溶液中加入酒精后会发生盐析而失去生理活性 |
7.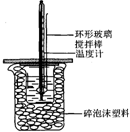 50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
(1)大小烧杯间填满碎泡沫塑料的作用是保温、隔热,减少热量散失.
(2)不能(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒.其原因是金属导热,导致热量散失.
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是偏低(填“偏高”“偏低”或“无影响”).
(4)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”“减少”或“不变”),理由是后者生成0.055molH2O,而前者只能生成0.050molH2O;所求中和热数值不变(填“增加”“减少”或“不变”),理由是中和热是指酸跟碱发生中和反应生成1molH2O时所放出的热量,与酸碱的用量无关;
(5)不能(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热.
(6)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值.该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.184×10-3kJ/(g•℃),则该反应的中和热为△H=-56.5kJ/mol(保留小数点后一位).
(7)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
 50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:(1)大小烧杯间填满碎泡沫塑料的作用是保温、隔热,减少热量散失.
(2)不能(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒.其原因是金属导热,导致热量散失.
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是偏低(填“偏高”“偏低”或“无影响”).
(4)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”“减少”或“不变”),理由是后者生成0.055molH2O,而前者只能生成0.050molH2O;所求中和热数值不变(填“增加”“减少”或“不变”),理由是中和热是指酸跟碱发生中和反应生成1molH2O时所放出的热量,与酸碱的用量无关;
(5)不能(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热.
(6)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值.该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度/t2/℃ | 温差(t2-t1)/℃ |
| 1 | 25.0 | 32.6 | |
| 2 | 25.1 | 31.8 | |
| 3 | 25.1 | 31.9 |
(7)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
17. 5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
分别取它们的水溶液进行实验,结果如下:①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6mol•L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断A、C的化学式为:ACuSO4;CBa(OH)2.
(2)写出步骤②中发生反应的化学方程式2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑.
(3)D溶液中滴入石蕊试液,现象是由无色变成红色,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式说明).
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是500mL.
(5)现用500mL 3mol•L-1的E溶液充分吸收11.2L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为c(H+)<c(OH-)<c(CO32-)<c(HCO3-)<c(Na+).
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水).
 5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.| 阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6mol•L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断A、C的化学式为:ACuSO4;CBa(OH)2.
(2)写出步骤②中发生反应的化学方程式2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑.
(3)D溶液中滴入石蕊试液,现象是由无色变成红色,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式说明).
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是500mL.
(5)现用500mL 3mol•L-1的E溶液充分吸收11.2L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为c(H+)<c(OH-)<c(CO32-)<c(HCO3-)<c(Na+).
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水).
4.下列表示对应化学反应的离子方程式正确的是( )
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 过量的SO2通入NaOH溶液中:SO2-+2OH-=SO32-+H2O | |
| D. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
1.化学资料表明:H-H、O=O、H-O键的键能分别是436kJ•mol-1、496kJ•mol-1和462kJ•mol-1,2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1,则C(s)+H2O(g)=CO(g)+H2(g)的反应热为( )
| A. | -332kJ | B. | -118kJ | C. | +130kJ•mol-1 | D. | +350kJ•mol-1 |