题目内容
15.已知CuO高温灼烧生成Cu2O,Cu2O与稀H2SO4反应的离子方程式:Cu2O+2H+═Cu+Cu2++H2O.现将经高温灼烧后的CuO样品投入足量稀硫酸中得到混合溶液,有关说法正确的是( )| A. | 反应中Cu2O只作氧化剂 | |
| B. | 若有28.8g Cu2O参加反应,则转移电子数为0.2NA | |
| C. | Cu2O的稳定性比CuO弱 | |
| D. | 如果溶液中出现蓝色,说明CuO已分解 |
分析 A.根据反应中Cu元素的化合价变化判断;
B.根据n=$\frac{m}{M}$计算出28.8g Cu2O物质的量,反应Cu2O+2H+═Cu+Cu2++H2O中,1mol氧化亚铜完全反应注意1mol电子,据此计算转移电子的物质的量及数目;
C.高温下氧化亚铜被氧化铜温度;
D.CuO与稀硫酸反应生成硫酸铜,溶液呈蓝色.
解答 解:A.反应Cu2O+2H+═Cu+Cu2++H2O中Cu元素的化合价从+1价升高+2价,部分降低到0价,则Cu2O既是氧化剂又是还原剂,故A错误;
B.反应Cu2O+2H+═Cu+Cu2++H2O中,1mol氧化亚铜完全反应注意1mol电子,28.8g Cu2O物质的量为:$\frac{28.8g}{144g/mol}$=0.2mol,0.2mol氧化亚铜完全反应转移了0.2mol电子,转移电子数为0.2NA,故B正确;
C.二者稳定性需要根据所处条件分析,在温度不是很高时CuO比氧化亚铜稳定,在高温的时候,氧化亚铜比氧化铜稳定,故C错误;
D.如果溶液中出现蓝色,不能说明CuO已分解,因为CuO与稀硫酸反应溶液也呈蓝色,故D错误;
故选B.
点评 本题考查铜及其化合物性质,题目难度不大,涉及氧化还原反应、物质的量的计算、物质稳定性判断等知识,明确氧化还原反应的实质为解答关键,注意掌握常见元素及其化合物性质.

练习册系列答案
相关题目
6.多巴胺的一种合成路线如图所示:

下列说法正确的是( )

下列说法正确的是( )
| A. | 原料甲与苯酚互为同系物 | |
| B. | 中间产物乙、丙和多巴胺都具有两性 | |
| C. | 多巴胺不可能存在氨基酸类的同分异构体 | |
| D. | 1 mol甲最多可以和2 mol Br2发生取代反应 |
3.下列说法中,正确的是( )
| A. | 二氧化硅可用来制造太阳能电池 | |
| B. | 需要加热才能进行的反应一定是吸热反应 | |
| C. | 铜的金属性比铝弱,可以用铜罐贮运浓硝酸 | |
| D. | NaOH溶液不能保存在带磨口玻璃塞的试剂瓶中 |
10.对于100mL1mol/L盐酸与铁片的反应,采取下列措施,其中不能使反应速率加快的是( )
| A. | 升高温度 | B. | 改用50mL2mol/L盐酸 | ||
| C. | 改用200mL1mol/L盐酸 | D. | 用等量铁粉代替铁片 |
20.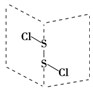 二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
 二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的空间构型与H2O2相似 | |
| B. | S2Cl2为含有极性键和非极性键的极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2<S2Cl2 | |
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
7.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性:H2Y>HZ | ||
| C. | 原子序数a>b>d>c | D. | a+3=c-2 |
4.金刚石和石墨是碳元素的两种结构不同的单质(同素异形体).在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能.试判断在100kPa时,下列结论正确的是( )
| A. | 金刚石比石墨稳定 | |
| B. | 1mol石墨比1mol金刚石的总能量高 | |
| C. | 若在等量氧气中充分燃烧,1mol金刚石比1mol石墨的释放的能量高 | |
| D. | 仅提供1.895 kJ的热能,工业上就能将1mol石墨转化为金刚石 |
5.下列说法正确的是( )
| A. | Li在氧气中燃烧主要生成Li2O2 | |
| B. | At位于第七周期第ⅦA族,其气态氢化物的稳定性比HCl的强 | |
| C. | 卤族元素单质的熔、沸点随原子序数的增大而升高 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后所得水溶液均呈酸性 |
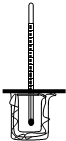 如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.
如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.