题目内容
5.下列说法正确的是( )| A. | Li在氧气中燃烧主要生成Li2O2 | |
| B. | At位于第七周期第ⅦA族,其气态氢化物的稳定性比HCl的强 | |
| C. | 卤族元素单质的熔、沸点随原子序数的增大而升高 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后所得水溶液均呈酸性 |
分析 A、Li金属性比Na的弱,不生成Li2O2;
B、非金属性越强,氢化物越稳定;
C、组成结构相似的分子晶体,相对分子质量越大,熔沸点越高;
D、氨气溶于水,溶液显碱性.
解答 解:A、Li金属性比Na的弱,Li与氧气反应不生成Li2O2,生成Li2O,故A错误;
B、非金属性越强,氢化物越稳定,同主族从上到下非金属性依次减弱,则氢化物的稳定性依次减弱,所以砹的氢化物的稳定性小于氯化氢,故B错误;
C、组成结构相似的分子晶体,相对分子质量越大,熔沸点越高,卤族元素单质随原子序数相对分子质量增大,则熔沸点升高,故C正确;
D、第二周期非金属元素的气态氢化物溶于水后,水溶液不一定为酸性,如氨气溶于水,溶液显碱性,故D错误;
故选C.
点评 本题考查了元素周期律和元素周期表的应用,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
15.已知CuO高温灼烧生成Cu2O,Cu2O与稀H2SO4反应的离子方程式:Cu2O+2H+═Cu+Cu2++H2O.现将经高温灼烧后的CuO样品投入足量稀硫酸中得到混合溶液,有关说法正确的是( )
| A. | 反应中Cu2O只作氧化剂 | |
| B. | 若有28.8g Cu2O参加反应,则转移电子数为0.2NA | |
| C. | Cu2O的稳定性比CuO弱 | |
| D. | 如果溶液中出现蓝色,说明CuO已分解 |
16.下列物质互为同分异构体的一组是( )
| A. | 白磷和红磷 | B. | 甲烷和丙烷 | ||
| C. | 1H和2H | D. | CH3CH2OH和CH3OCH3 |
13.目前已知化合物中数量、品种最多的是碳的化合物,下列关于其原因的叙述中不正确的是( )
| A. | 碳原子之间,碳原子与其他原子(如氢原子)之间都可以形成4个共价键 | |
| B. | 碳原子性质活泼,可以与多数非金属元素原子形成共价键 | |
| C. | 碳原子之间既可以形成稳定的单键,又可以形成双键和三键 | |
| D. | 多个碳原子可以形成长度不同的链及环,且链、环之间又可以相互结合 |
20.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝.关于${\;}_{116}^{203}$Lv的叙述错误的是( )
| A. | 原子序数116 | B. | 中子数177 | C. | 核外电子数116 | D. | 质子数177 |
9.已知:Ksp[Mg(OH)2]=1.8×10-11 Ksp[Zn(OH)2]=1.0×10-17
Ksp[Cr(OH)3]=7.0×10-31 Ksp[Fe(OH)3]=4.0×10-38
若将浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+四种离子组成溶液的pH控制在9附近,溶液中四种离子的浓度由大到小排列顺序正确是( )
Ksp[Cr(OH)3]=7.0×10-31 Ksp[Fe(OH)3]=4.0×10-38
若将浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+四种离子组成溶液的pH控制在9附近,溶液中四种离子的浓度由大到小排列顺序正确是( )
| A. | Mg2+、Zn2+、Cr3+、Fe3+ | B. | Cr3+、Fe3+、Zn2+、Mg2+ | ||
| C. | Fe3+、Cr3+、Zn2+、Mg2+ | D. | Zn2+、Mg2+、Cr3+、Fe3+ |
10.铅蓄电池是常见的二次电池,某学生用铅蓄电池进行下列实验,如图所示.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.下列判断错误的是( )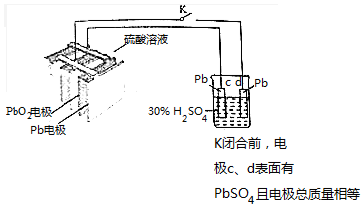

| A. | 铅蓄电池的结构中栅状极板应交替排列 | |
| B. | 铅蓄电池放电时Pb电极的电极反应为:Pb-2e-═Pb2+ | |
| C. | K闭合时,烧杯中SO42-向c电极迁移 | |
| D. | K闭合后,若c、d电极的质量相差3.2g,则转移的电子可能为0.2mol |