题目内容
10.对于100mL1mol/L盐酸与铁片的反应,采取下列措施,其中不能使反应速率加快的是( )| A. | 升高温度 | B. | 改用50mL2mol/L盐酸 | ||
| C. | 改用200mL1mol/L盐酸 | D. | 用等量铁粉代替铁片 |
分析 升高温度、增大浓度、增大接触面积均可加快反应速率,以此来解答.
解答 解:A.升高温度,反应速率加快,故A不选;
B.改用50mL2mol/L盐酸,浓度增大,反应速率加快,故B不选;
C.改用200mL1mol/L盐酸,浓度不变,反应速率不变,故C选;
D.用等量铁粉代替铁片,接触面积增大,反应速率加快,故D不选;
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度、接触面积对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.

练习册系列答案
相关题目
1.某酸性废液含有H+、Fe3+、Ni2+、NO3-、F─和Cr2O72─等.图是该废液的综合利用工艺流程:(假设:F─与金属离子的络合反应不影响其他反应和计算)

已知:
①金属离子开始沉淀和沉淀完全时的pH:
②Ni2+与足量氨水的反应为:Ni2++6NH3?[Ni(NH3)6]2+
(1)滤渣1的主要成份为:Fe(OH)3.
(2)请写出“转化”时NaHSO3与Cr2O72─发生反应的离子方程式Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(3)试剂X可以是足量氨水,还可以是:BC.A.NaOH B.Ni(OH)2 C.NiO D.Fe2O3
(4)写出Cr(OH)3在水中的电离方程式Cr(OH)3?Cr3++3OH-,Cr(OH)3+H2O?[Cr(OH)4]-+H+.
(5)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(6)请写出Cr3+与酸性高锰酸钾发生反应的离子方程式10Cr3++6MnO4-+11H2O=6Mn2++5Cr2O72-+22H+.
(7)经检测,最后的残液中c(Ca2+)=1.0×10─5 mol•L-1,则残液中F-浓度为38mg•L-1,
不符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10─11,国家排放标准要求氟离子浓度小于10mg•L-1].

已知:
①金属离子开始沉淀和沉淀完全时的pH:
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
(1)滤渣1的主要成份为:Fe(OH)3.
(2)请写出“转化”时NaHSO3与Cr2O72─发生反应的离子方程式Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(3)试剂X可以是足量氨水,还可以是:BC.A.NaOH B.Ni(OH)2 C.NiO D.Fe2O3
(4)写出Cr(OH)3在水中的电离方程式Cr(OH)3?Cr3++3OH-,Cr(OH)3+H2O?[Cr(OH)4]-+H+.
(5)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3.
(6)请写出Cr3+与酸性高锰酸钾发生反应的离子方程式10Cr3++6MnO4-+11H2O=6Mn2++5Cr2O72-+22H+.
(7)经检测,最后的残液中c(Ca2+)=1.0×10─5 mol•L-1,则残液中F-浓度为38mg•L-1,
不符合(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10─11,国家排放标准要求氟离子浓度小于10mg•L-1].
18.下列各式表示水解反应的是( )
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | HSO3-+H2O?SO32-+H3O+ | D. | HCO3-+OH-?H2O+CO32- |
5.下列反应过程中的能量变化与如图相符的是( )


| A. | 金属钠和水反应 | B. | 生石灰变成熟石灰的反应 | ||
| C. | Al和Fe2O3的铝热反应 | D. | CaCO3受热分解 |
15.已知CuO高温灼烧生成Cu2O,Cu2O与稀H2SO4反应的离子方程式:Cu2O+2H+═Cu+Cu2++H2O.现将经高温灼烧后的CuO样品投入足量稀硫酸中得到混合溶液,有关说法正确的是( )
| A. | 反应中Cu2O只作氧化剂 | |
| B. | 若有28.8g Cu2O参加反应,则转移电子数为0.2NA | |
| C. | Cu2O的稳定性比CuO弱 | |
| D. | 如果溶液中出现蓝色,说明CuO已分解 |
2.下列说法不正确的是( )
| A. | 12C与14C为不同核素 | B. | 石墨和C60互为同素异形体 | ||
| C. | O2和O3互为同位素 | D. | ${\;}_{17}^{35}$X与${\;}_{17}^{37}$Y 为同种元素 |
19.下列有关化学用语表示正确的是( )
| A. | Mg原子的结构示意图: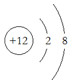 | B. | OCl2分子的电子式: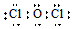 | ||
| C. | HF分子的电子式: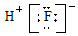 | D. | Na2S形成的电子式 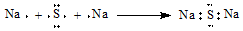 |
20.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝.关于${\;}_{116}^{203}$Lv的叙述错误的是( )
| A. | 原子序数116 | B. | 中子数177 | C. | 核外电子数116 | D. | 质子数177 |