题目内容
5.2015年8月28日,由中国稀土行业协会储氢材料分会主办的“2015中国稀土储氢论坛”在山东省枣庄召开,与会代表共同研究解决储氢合金产业化发展过程中存在的各类问题,为储氢材料未来的发展寻求创新之路.钛(Ti)、钒(V)、镍(Ni)、镧(La)等在储氢材料方面具有广泛的用途.下面是一些晶体材料的结构示意图.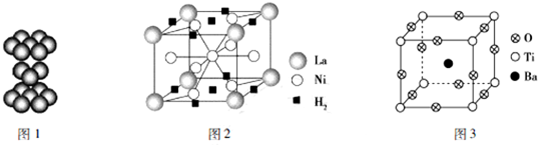
请回答下列问题:
(1)写出镍原子的核外电子排布式:1s22s22p63s23p63d84s2.
(2)钛金属晶体的原子堆积方式如图1所示,则每个钛原子周围有12个紧邻的钛原子.
(3)镧系合金是稀土系储氢合金的典型代表.某合金储氢后的晶胞如图2所示,该合金的化学式为LaNi5,1mol镧形成的该合金能储存3mol氢气.
(4)嫦娥三号卫星上的PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构如图3所示,该晶体经X射线分析鉴定,重复单位为立方体,边长为acm.顶点位置被Ti4+所占据,体心位置被Ba2+所占据,所有棱心位置被O2-所占据.
①该晶体中的O元素与H形成的简单化合物的中心原子的杂化类型为sp3,其分子空间构型为V形.
②写出该晶体的化学式:BaTiO3.
③若该晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则a=$\root{3}{\frac{233}{ρ{N}_{A}}}$cm.
分析 (1)Ni原子核外电子数为28,根据能量最低原理书写核外电子排布式;
(2)由钛晶体的原子堆积方式可知,属于六方最密堆积;
(3)根据均摊法计算晶胞中La、Ni原子数目,进而确定化学式;计算晶胞中氢气分子数目,结合晶胞中La与氢气分子数目之比计算1mol镧形成的该合金能储存氢气物质的量;
(4)①该晶体中的O元素与H形成的简单化合物为H2O,O原子形成2个O-H键,含有2对孤对电子;
②根据均摊法计算晶胞中O、Ti、Ba原子数目,进而确定化学式;
③结合晶胞含有原子数目计算晶胞质量,再根据V=$\frac{m}{ρ}$计算晶胞体积,晶胞边长=$\root{3}{{V}_{晶胞}}$.
解答 解:(1)Ni原子核外电子数为28,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)由钛晶体的原子堆积方式可知,属于六方最密堆积,原子配位数为12,即每个钛原子周围有12个紧邻的钛原子,
故答案为:12;
(3)算晶胞中La原子数目为8×$\frac{1}{8}$=1、Ni原子数目=1+8×$\frac{1}{2}$=5,故合金的化学式为LaNi5,晶胞中氢气分子数目为2×$\frac{1}{2}$+8×$\frac{1}{4}$=3,1mol镧形成的该合金能储存氢气物质的量为3mol,
故答案为:LaNi5;3;
(4)①该晶体中的O元素与H形成的简单化合物为H2O,O原子形成2个O-H键,含有2对孤对电子,氧原子采取sp3杂化,空间构型为V形,
故答案为:sp3;V形;
②晶胞中O氧原子数目为12×$\frac{1}{4}$=3、Ti原子数目为8×$\frac{1}{8}$=1、Ba原子数目1,故化学式为:BaTiO3,
故答案为:BaTiO3;
③晶胞质量=$\frac{137+48+16×3}{{N}_{A}}$g,晶体的密度为ρg/cm3,则晶胞边长=$\root{3}{\frac{\frac{233}{{N}_{A}}g}{ρg•c{m}^{-3}}}$=$\root{3}{\frac{233}{ρ{N}_{A}}}$cm,
故答案为:$\root{3}{\frac{233}{ρ{N}_{A}}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、晶胞结构与计算等,注意理解金属晶体的堆积方式,对学生的空间想象有一定的要求,难度中等.

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案| A. | 升高温度,KW增大,pH变小 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸,c(H+)增大,KW变小 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |

| A. | M是直流电的正极 | B. | 电子流向是N→b→a→M | ||
| C. | 电解过程中,水是氧化剂 | D. | b电极附近溶液的pH变小 |
| A. | 在NaHS溶液中滴入少量的CuCl2溶液产生黑色沉淀,HS-电离程度增大,反应后溶液pH减小 | |
| B. | 浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸 | |
| C. | 在等浓度NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl,则Ksp(AgCl)<Ksp(Ag2CrO4) | |
| D. | 等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小 |
| A. | 复分解反应一定都不属于氧化还原反应 | |
| B. | 在氧化还原反应中,反应物中的金属单质不一定是还原剂 | |
| C. | 在氧化还原反应中,非金属单质不一定是氧化剂 | |
| D. | 置换反应一定都属于氧化还原反应 |
| A. | l molH2O (I)变成lmolH2O (g),向外界释放能量 | |
| B. | 1molH2O (g)分解成H2(g)和O2(g),吸收241. 8kJ能量 | |
| C. | 2mol H2(g)和l mol O2(g)的总能量小于2molH2O(1)的能量 | |
| D. | 断裂2molH2O (g)中所有的O-H键,吸收483.6 kJ能量 |
| A. | 铂电极做成网状,可增大与氧气的接触面积 | |
| B. | 该电池通常只需要更换铝板就可继续使用 | |
| C. | 海洋电池中铝板充当负极,发生氧化反应 | |
| D. | 负极反应为:O2+H20+2e-=2OH- |
| A. | Y、Z的氧化物都有两性 | |
| B. | 气态氢化物的稳定性:Z>X | |
| C. | 原子半径:W>Y>Z>X | |
| D. | 最高价氧化物对应水化物的碱性:W<Y |