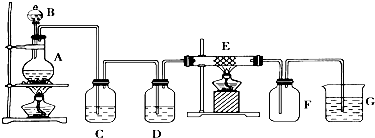
题目内容
17.我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为:4Al+3O2+6H2O=4A1(OH)3,下列判断错误的是( )| A. | 铂电极做成网状,可增大与氧气的接触面积 | |
| B. | 该电池通常只需要更换铝板就可继续使用 | |
| C. | 海洋电池中铝板充当负极,发生氧化反应 | |
| D. | 负极反应为:O2+H20+2e-=2OH- |
分析 根据电池反应式知,Al失电子作负极、Pt作正极,Al电极反应式为Al-3e-+3OH-=Al(OH)3,正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,据此分析解答.
解答 解:A.反应物接触面积越大,反应速率越快,所以铂电极做成网状,可增大与氧气的接触面积,加快反应速率,故A正确;
B.Al不断反应,不断溶解,所以一段时间后,更换铝板就可以继续使用,故B正确;
C.Al失电子发生氧化反应,则Al作负极,故C正确;
D.负极反应式为Al-3e-+3OH-=Al(OH)3,正极反应式为O2+2H2O+4e-=4OH-,故D错误;
故选D.
点评 本题考查化学电源新型电池,为高频考点,明确正负极上发生的反应及原电池原理是解本题关键,会正确书写电极反应式,题目难度不大.

练习册系列答案
相关题目
7.用NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A. | 标准状况下,22.4LH2含有的分子数为1NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+数为0.02NA | |
| C. | 标准状况下,1NACO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
8. 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三.
假设一:全部是FeO
假设二:全部是Fe3O4
假设三:是FeO和Fe3O4的混合物
(3)为验证上述假设一是否成立,课题组进行如下研究.
定性研究:请你完成如表中内容.
定量研究:课题组在文献中查阅到,FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4•2H2O晶体受热分解得到的固体产物的化学式为:FeO.
 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三.
假设一:全部是FeO
假设二:全部是Fe3O4
假设三:是FeO和Fe3O4的混合物
(3)为验证上述假设一是否成立,课题组进行如下研究.
定性研究:请你完成如表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体 |
12.中美研究人员在新一期美国(环境科学与技术)杂志上报告说,黄粉虫可以吞食和完全降解塑料.他们已在黄粉虫体内分离出靠聚苯乙烯生存的细菌,并将其保存.聚苯乙烯属于( )
| A. | 合金 | B. | 硅酸盐材料 | C. | 有机高分子材料 | D. | 无机非金属材料 |
9.(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1.已知18g液态水转化成水蒸气需吸热44kJ,则反应2H2(g)+O2(g)═2H2O(l)的△H=-571.6kJ•mol-1,氢气的标准燃烧热△H=-285.8kJ•mol-1.
(2)已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1.其它相关数据如下表:
则表中a为431.8.
(3)已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)═2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
(2)已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1.其它相关数据如下表:
| H2(g) | Cl2 (g) | HCl (g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 243 | a |
(3)已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)═2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
 有关物质的转化关系如图所示(部分物质与条件己略去).A中只含两种元素且质量比为7:8,B和C为无色气体单质,D是一种能导致酸雨的有害气体,E为红棕色固体,F为最常见的液体,G为黄绿色气体,J在H的浓溶液中会发生钝化.
有关物质的转化关系如图所示(部分物质与条件己略去).A中只含两种元素且质量比为7:8,B和C为无色气体单质,D是一种能导致酸雨的有害气体,E为红棕色固体,F为最常见的液体,G为黄绿色气体,J在H的浓溶液中会发生钝化.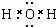 .
.