题目内容
15.某矿石由前20号元素中的四种组成,其化学式为WYZX4.X、Y、Z、W分布在三个周期,且原子序数依次增大,Y、Z处于相邻主族,Y、W为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等.则下列判断正确的是( )| A. | Y、Z的氧化物都有两性 | |
| B. | 气态氢化物的稳定性:Z>X | |
| C. | 原子半径:W>Y>Z>X | |
| D. | 最高价氧化物对应水化物的碱性:W<Y |
分析 某矿石由前20号元素中的四种组成,其化学式为WYZX4.X、Y、Z、W分布在三个周期,且 原子序数依次增大,Y、Z处于相邻主族,X原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故X为O元素;Y、Z处于相邻主族,Y、W为金属元素,则Y、Z为第三周期元素,W为第四周期元素,若W为K元素,则Y、Z最外层电子数之和等于7,可得Y元素为Al元素、Z元素为Si元素;若W为Ca元素,则Y、Z最外层电子数之和等于8不符合题意.
解答 解:某矿石由前20号元素中的四种组成,其化学式为WYZX4.X、Y、Z、W分布在三个周期,且 原子序数依次增大,Y、Z处于相邻主族,X原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故X为O元素;Y、Z处于相邻主族,Y、W为金属元素,则Y、Z为第三周期元素,W为第四周期元素,若W为K元素,则Y、Z最外层电子数之和等于7,可得Y元素为Al元素、Z元素为Si元素;若W为Ca元素,则Y、Z最外层电子数之和等于8不符合题意.
A.AL2O3为两性氧化物,而SiO2不是两性氧化物,故A错误;
B.O元素的非金属性比Si元素非金属性强,氢化物稳定性更强,故B错误;
C.根据电子层数越多半径越大,同一周期从左到右半径越小,故原子半径:W(K)>Y(Al)>Z(Si)>X(O),故C正确;
D.最高价氧化物对应的水化物碱性强弱与元素的金属性强弱有关,由于K元素金属性比Al元素金属性强,故KOH的碱性比氢氧化铝的强,故D错误.
故选C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,熟练掌握元素周期表结构,注意对元素周期律的理解掌握.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
3.下列关于元素的叙述正确的是( )
| A. | 氟元素的非金属性最强,所以氢氟酸的酸性最强 | |
| B. | 元素的金属性越强,其最外层电子数就越少 | |
| C. | 在天然元素中,都含有同位素 | |
| D. | 某元素的原子及其阴离子的核外电子层数等于该元素所在的周期数 |
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 78g由Na2S和Na2O2组成的固体混合物,含有的阴离子数为NA | |
| B. | 标准状况下,22.4L CCl4中含有的分子数为NA | |
| C. | 1mol Cu分别与足量的Cl2和S反应,转移电子数均为2NA | |
| D. | 1mol•L-1 FeCl3溶液中含有的Fe3+数目小于NA |
 有关物质的转化关系如图所示(部分物质与条件己略去).A中只含两种元素且质量比为7:8,B和C为无色气体单质,D是一种能导致酸雨的有害气体,E为红棕色固体,F为最常见的液体,G为黄绿色气体,J在H的浓溶液中会发生钝化.
有关物质的转化关系如图所示(部分物质与条件己略去).A中只含两种元素且质量比为7:8,B和C为无色气体单质,D是一种能导致酸雨的有害气体,E为红棕色固体,F为最常见的液体,G为黄绿色气体,J在H的浓溶液中会发生钝化. .
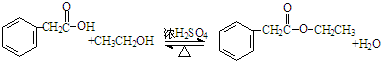
. +CH3CO+HBr$\stackrel{ZnCI_{2}}{→}$
+CH3CO+HBr$\stackrel{ZnCI_{2}}{→}$ +H2O(卤烷基化反应)
+H2O(卤烷基化反应) +R′-X$\stackrel{一定条件}{→}$
+R′-X$\stackrel{一定条件}{→}$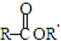 +NaX
+NaX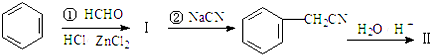 $\stackrel{NaOH}{→}$Ⅲ$\stackrel{一定条件}{→}$Ⅳ(C15H14O2)
$\stackrel{NaOH}{→}$Ⅲ$\stackrel{一定条件}{→}$Ⅳ(C15H14O2)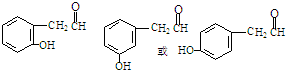 .
.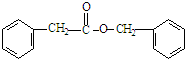 .
. .
. .
.

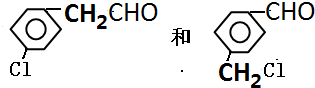
 ;壬的结构简式
;壬的结构简式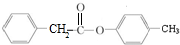


 (任写一种)
(任写一种)
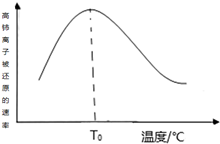 高铈离子被还原的速率与温度的关系如图所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是高铈离子被还原的反应,正反应为放热反应,开始反应时,反应物浓度大,反应速率快,正反应为放热反应,温度逐渐升高,反应速率加快,温度高于T0℃时,反应物的浓度减少,反应速率减小,温度对反应速率的影响不及浓度的影响.
高铈离子被还原的速率与温度的关系如图所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是高铈离子被还原的反应,正反应为放热反应,开始反应时,反应物浓度大,反应速率快,正反应为放热反应,温度逐渐升高,反应速率加快,温度高于T0℃时,反应物的浓度减少,反应速率减小,温度对反应速率的影响不及浓度的影响.