题目内容
15.已知水的电离方程式:H2O?H++OH-.下列叙述中,正确的是( )| A. | 升高温度,KW增大,pH变小 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸,c(H+)增大,KW变小 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
分析 水的电离过程是吸热过程,升温促进电离,加入酸或碱抑制水的电离,加入能水解的盐促进水的电离,依据影响水电离的因素分析判断即可解答.
解答 解:A.水的电离方程式:H2O?H++OH-,KW=c(OH-)×c(H+),常温下,水的离子积常数为Kw=10-14,水的电离为吸热过程,升高温度,KW增大,氢离子浓度变大,pH=-lg〔H+〕,氢离子浓度越大,pH值越小,故A正确;
B.向水中加入氨水,氨水是弱碱,弱碱氨水电离出的氢氧根离子,对于H2O?H++OH-,平衡向逆反应方向移动,抑制水的电离,但氨水电离出的氢氧根离子比水平衡向右移动减少的氢氧根离子多,所以总体c(OH-)增大,故B错误;
C.向水中加入少量硫酸,硫酸是强酸,完全电离,溶液中氢离子浓度增大,水的离子积常数,与温度有关,与离子浓度无关,所以温度不变,KW不变,故C错误;
D.乙酸钠为弱酸强碱盐,向水中加入少量固体CH3COONa,乙酸根离子与水电离出的氢离子结合,生成弱电解质乙酸,促进水的电离,平衡向正反应方向移动,故D错误;故选A.
点评 本题主要考查了水的电离的影响因素,解答的关键是理解平衡移动的原因.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
5.电解100mL含c(H+)=0.30mol•L-1的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
| A. | 0.10 mol•L-1AgNO3 | B. | 0.20 mol•L-1Zn(NO3)2 | ||
| C. | 0.20 mol•L-1Cu(NO3)2 | D. | 0.20 mol•L-1Pb(NO3)2 |
20.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L-1;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 元素原子第一电离能大小关系:Z>Y>W>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线形的共价化合物 | |
| C. | Y与M形成化合物键长大于Z与M形成化合物的键长 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
7.用NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A. | 标准状况下,22.4LH2含有的分子数为1NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+数为0.02NA | |
| C. | 标准状况下,1NACO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
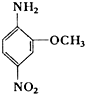 2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )
2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )