题目内容
16.取一张用饱和NaCl溶液浸泡的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色.则下列说法错误的是( )
| A. | M是直流电的正极 | B. | 电子流向是N→b→a→M | ||
| C. | 电解过程中,水是氧化剂 | D. | b电极附近溶液的pH变小 |
分析 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,说明a极负极先产生了Cl2,漂白pH试纸变白,后OH-离子放电产生氧气,H+相对剩余呈酸性,使pH试纸外圈呈红色,所以a极与电源的正极相连,即a为阳极,电极反应式为:2Cl--2e-═Cl2↑,b为阴极,电极方程式为2H2O-4e-═H2↑+2OH-,据此分析解答.
解答 解:a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,说明a极负极先产生了Cl2,漂白pH试纸变白,后OH-离子放电产生氧气,H+相对剩余呈酸性,使pH试纸外圈呈红色,所以a极与电源的正极相连,即a为阳极,电极反应式为:2Cl--2e-═Cl2↑,b为阴极,电极方程式为2H2O-4e-═H2↑+2OH-,
A.外圈呈浅红色,说明溶液显碱性,因此a电极是阴极,氢离子放电,所以M是电源的负极,故A不选;
B.电子从负极流向阴极、从阳极流向正极,所以电子流向是N→b、a→M,电子不进入溶液,故B选;
C.电解过程中,水得电子生成氢气,则水是氧化剂,故C不选;
D.b电极方程式为2H2O-4e-═H2↑+2OH-,溶液碱性增强,溶液的pH增大,故D选;
故选BD.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断能力,正确判断正负极、阴阳极是解本题关键,易错选项是B,注意电子不进入电解质溶液,电解质溶液中阴阳离子通入定向移动形成电流,题目难度不大.

练习册系列答案
相关题目
7.用NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A. | 标准状况下,22.4LH2含有的分子数为1NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+数为0.02NA | |
| C. | 标准状况下,1NACO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
4. 2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )
2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )
 2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )
2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )| A. | 6种 | B. | 7种 | C. | 9种 | D. | 10种 |
8. 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三.
假设一:全部是FeO
假设二:全部是Fe3O4
假设三:是FeO和Fe3O4的混合物
(3)为验证上述假设一是否成立,课题组进行如下研究.
定性研究:请你完成如表中内容.
定量研究:课题组在文献中查阅到,FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4•2H2O晶体受热分解得到的固体产物的化学式为:FeO.
 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三.
假设一:全部是FeO
假设二:全部是Fe3O4
假设三:是FeO和Fe3O4的混合物
(3)为验证上述假设一是否成立,课题组进行如下研究.
定性研究:请你完成如表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体 |
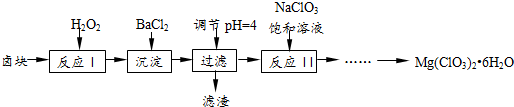
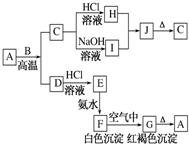 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
 有关物质的转化关系如图所示(部分物质与条件己略去).A中只含两种元素且质量比为7:8,B和C为无色气体单质,D是一种能导致酸雨的有害气体,E为红棕色固体,F为最常见的液体,G为黄绿色气体,J在H的浓溶液中会发生钝化.
有关物质的转化关系如图所示(部分物质与条件己略去).A中只含两种元素且质量比为7:8,B和C为无色气体单质,D是一种能导致酸雨的有害气体,E为红棕色固体,F为最常见的液体,G为黄绿色气体,J在H的浓溶液中会发生钝化. .
.