题目内容
3.下列实验方案中,正确的是( )| A. | 证明NaOH和盐酸恰好完全反应:在反应后的溶液中加入酚酞溶液 | |
| B. | 检验碳酸根离子:将要检验的物质与稀盐酸混合,观察是否产生气泡 | |
| C. | 制备NaOH溶液:将饱和的Na2CO3溶液与适量的石灰水混合后过滤 | |
| D. | 验证质量守恒定律:用NH4Cl溶液与NaOH溶液混合加热,比较反应前后溶液的质量 |
分析 氢氧化钠溶液显碱性,能使酚酞试液变红色,稀盐酸显酸性,不能使酚酞试液变色,反应生成的氯化钠显中性,不能使酚酞试液变色;
碳酸根离子能和稀盐酸反应生成二氧化碳,亚硫酸根离子能和稀盐酸反应生成二氧化硫;
碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
氯化铵和氢氧化钠反应生成氯化钠、水和氨气.
解答 解:A、氢氧化钠恰好和稀盐酸完全反应时,滴加酚酞试液时,酚酞试液不变色,稀盐酸过量时,溶液显酸性,滴加酚酞试液时,酚酞试液不变色,因此在反应后的溶液中加入酚酞溶液,不能证明氢氧化钠和稀盐酸是否恰好完全反应;
B、将要检验的物质与稀盐酸混合,如果产生气泡,说明溶液中可能含有碳酸根离子,也可能含有亚硫酸根离子,因此将要检验的物质与稀盐酸混合,通过观察是否产生气泡不能确定溶液中是否含有碳酸根离子;
C、将饱和的Na2CO3溶液与适量的石灰水混合后,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,过滤除去碳酸钙,即可得到氢氧化钠溶液;
D、氯化铵和氢氧化钠反应生成氯化钠、水和氨气,生成的氨气从溶液中逸出,因此不能用NH4Cl溶液与NaOH溶液混合加热,比较反应前后溶液的质量来验证质量守恒定律.
故选:C.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 春天是流感的多发季节,民间有很多治疗流感的土方法,其中多吃大蒜能预防感冒.大蒜中的大蒜素硫化丙烯是杀菌的有效成分,1千克大蒜中含大蒜素125克,已知大蒜素由C、H、S三种元素组成,相对分子质量为74,其中碳元素质量分数48.6%,氢元素质量分数8.1%,求:
春天是流感的多发季节,民间有很多治疗流感的土方法,其中多吃大蒜能预防感冒.大蒜中的大蒜素硫化丙烯是杀菌的有效成分,1千克大蒜中含大蒜素125克,已知大蒜素由C、H、S三种元素组成,相对分子质量为74,其中碳元素质量分数48.6%,氢元素质量分数8.1%,求: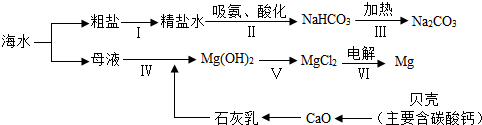
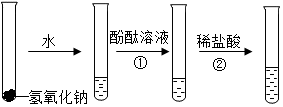 如图是有关氢氧化钠的性质实验,请简要描述实验①②可能出现的现象并从微观角度解释实验②的反应实质:
如图是有关氢氧化钠的性质实验,请简要描述实验①②可能出现的现象并从微观角度解释实验②的反应实质:
