题目内容
15.已知木炭还原氧化铜实验中发生的主要反应:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,某化学兴趣小组对该实验红色固体产物的成份(假设反应物已完全反应)作如下探究:探究一:检验红色固体产物的成份
【查阅资料】Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;
Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】
假设1:红色固体只含Cu; 假设2:红色固体只含Cu2O;
假设3:红色固体为Cu和Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
该化学兴趣小组经交流讨论后,设计了如下方案:
【方案】称取5.00g的红色固体,用如下图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
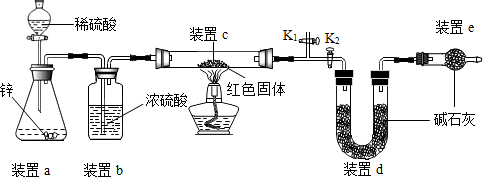
(1)装置a中用稀硫酸而不用稀盐酸,原因是稀盐酸有挥发性,干扰实验;
(2)装置b的作用是吸收水蒸气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中的二氧化碳和水蒸气进入d装置,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;
②检查装置气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防止发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行验纯;
④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的质量分数(写出计算过程,最后结果保留小数点后1位);
【交流与反思】
方案中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.
分析 探究一:【猜想与假设】因为Cu和Cu2O均为不溶于水的红色固体,则根据假设1、2,推测假设3;
【设计实验】如果暗红色固体中含有Cu2O,加入稀硫酸时,Cu2O和稀硫酸反应生成硫酸铜,硫酸铜溶液是蓝色的;
探究二:
【方案】
(1)盐酸易挥发,容易挥发出氯化氢气体;
(2)考虑浓硫酸的吸水干燥作用;
(3)装置c中涉及的反应为:氢气与Cu2O生成铜与水;
(4)空气中含有水蒸气和二氧化碳,能够被碱石灰吸收;
(5)正确的顺序是:先连接仪器,检查装置的气密性,再关闭K2,打开K1,通氢气一段时间,把装置中的水蒸气和二氧化碳排出,再打开K2,关闭K1,点燃酒精灯;
(6)根据化学方程式化和质量守恒定律,计算产物中Cu2O的含量;
【交流与反思】根据通过测定反应前后c装置的质量也可以达到实验目的解答.
解答 解:探究一:
【猜想与假设】因为Cu和Cu2O均为不溶于水的红色固体,则根据假设1、2,推测假设3为红色固体Cu、Cu2O的混合物;
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到固体部分溶解,溶液变成蓝色,即Cu2O+H2SO4=CuSO4+Cu+H2O,说明暗红色固体含有Cu2O.
探究二:
【方案】
(1)装置a中用稀硫酸而不用稀盐酸,原因是盐酸易挥发,挥发出的氯化氢能被碱石灰吸收,影响测定结果.
(2)装置b的作用是 干燥氢气,若不加装置b,实验结果会偏大;
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)若不加装置e,实验结果会偏高,原因是d中的碱石灰能够吸收空气中的水和二氧化碳,从而使测定的水的质量偏高,会导致计算的Cu2O的质量偏高,从而导致实验结果会偏大;
(5)点燃酒精灯前涉及的部分操作如下,①连接仪器;②检查装置的气密性;③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防氢气不纯,发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行点燃实验;④打开K2,关闭K1;
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,则根据质量守恒定律,生成水的质量为100.18g-100.00g=0.18g,则设产物中Cu2O的含量为x.
Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O
144 18
x 0.18g
$\frac{144}{x}=\frac{18}{0.18g}$
x=1.44g
产物中Cu2O的质量分数=$\frac{1.44g}{5g}×$100%=28.8%
【交流与反思】
还可通过测定反应前后装置c的质量达到实验目的,反应前后装置c的质量差即为Cu2O中氧元素的质量,根据氧元素的质量可以计算Cu2O的质量,进一步可以计算产物中Cu2O的含量.故填:c.
答案:
【猜想与假设】
红色固体为Cu和Cu2O的混合物
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体 部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
(1)稀盐酸有挥发性,干扰实验
(2)吸收水蒸气 偏大
(3)Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O
(4)防止空气中的二氧化碳和水蒸气进入d装置
(5)检查装置气密性 发生爆炸 验纯
(6)产物中Cu2O的质量分数为28.8%
反思:C
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

 阅读快车系列答案
阅读快车系列答案| A化学与生活 | B化学与健康 |
| ①除锈迹-用醋酸 ②去餐具油污-用洗洁精乳化 ③硬水软化-用肥皂水 ④去手上油渍-用汽油溶解 | ①人体缺乏维生素C-引起夜盲症 ②人体摄入过量食盐-引起高血压 ③人体缺铁-引起贫血 ④不能用甲醛的水溶液浸泡海产品保鲜 |
| C化学中常见的“三” | D化学概念中的不一定 |
| ①工业上的三大化石燃料-煤、石油、天然气 ②三大合成材料-合金、合成纤维、合成橡胶 ③三种还原性物质-碳、氢气、一氧化碳 ④构成原子的三种粒子-质子、中子、电子 | ①酸溶液通常呈酸性,但酸性溶液不一定是酸溶液 ②中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应 ③氧化物一定由两种元素组成,但由两种元素组成的物质不一定是氧化物 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 公民应增强环保意识,采取低碳、节俭的生活方式,自觉履行环境保护的义务 | |
| B. | 将秸秆综合利用率达100%,以杜绝秸秆焚烧现象 | |
| C. | 增加以燃煤为主的火力发电厂,为城市提供更多的电力保障 | |
| D. | 对工业污水作处理使之符合排放标准,防止水体污染 |
 如图所示是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点,据图回答:
如图所示是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点,据图回答: