题目内容
3. 如图所示是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点,据图回答:
如图所示是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点,据图回答:(1)在t2℃时,a、b、c三种物质的饱和溶液能通过降温使其变为不饱和溶液的是c
(2)在t2℃时,将50g a物质加入50g水中充分搅拌溶解,所得溶液溶质质量分数为33.3%
(3)t1℃时,用托盘天平称取15g a物质于一个烧杯中,再用100mL量筒量取75mL水加入烧杯中充分搅拌溶解即得a的饱和溶液.
①若量取水时仰视读数,则所得溶液为不饱和溶液(填“饱和”、“不饱和”或“过饱和”)
②若称取a物质时a与砝码位置放反了(10g以下用游码),则所得溶液的质量分数为6.25%
(4)在t2℃时,将a、b、c三种物质的不饱和溶液变为饱和溶液,都适用的方法有增加溶质、蒸发溶剂.
(5)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是C.
A.a>b>c B.c>a=b C.b>a>c D.a=b>c.
分析 根据题目信息和溶解度曲线可知:a、b两种固体物质的溶解度,都是随温度升高而增大,而c的溶解度随温度的升高而减少;在t2℃时,a、b、c三种物质的饱和溶液能通过降温使其变为不饱和溶液的是c,因为c的溶解度随温度的升高而减少;在t2℃时,将50ga物质加入50g水中充分搅拌溶解,所得溶液溶质质量分数=$\frac{50g}{150g}×100%≈33.3%$;t1℃时,用托盘天平称取15ga物质于一个烧杯中,再用100mL量筒量取75mL水加入烧杯中充分搅拌溶解即得a的饱和溶液,因为在该温度下a的溶解度是50g;若量取水时仰视读数,水实际量多了,则所得溶液为不饱和溶液;若称取a物质时a与砝码位置放反了(10g以下用游码),则所得溶液的质量分数=$\frac{5g}{5g+75g}×100%=6.25%$;在t2℃时,将a、b、c三种物质的不饱和溶液变为饱和溶液,都适用的方法有:增加溶质;蒸发溶剂;将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是:b>a>c,升温后,a、b的质量分数不变,c的质量分数减小.
解答 解:(1)在t2℃时,a、b、c三种物质的饱和溶液能通过降温使其变为不饱和溶液的是c,因为c的溶解度随温度的升高而减少;故答案为:c;
(2)在t2℃时,将50ga物质加入50g水中充分搅拌溶解,所得溶液溶质质量分数=$\frac{50g}{150g}×100%≈33.3%$;故答案为:33.3%;
(3)t1℃时,用托盘天平称取15ga物质于一个烧杯中,再用100mL量筒量取75mL水加入烧杯中充分搅拌溶解即得a的饱和溶液,因为在该温度下a的溶解度是50g;若量取水时仰视读数,水实际量多了,则所得溶液为不饱和溶液;若称取a物质时a与砝码位置放反了(10g以下用游码),则所得溶液的质量分数=$\frac{5g}{5g+75g}×100%=6.25%$;故答案为:100;75;不饱和;6.25%;
(4)在t2℃时,将a、b、c三种物质的不饱和溶液变为饱和溶液,都适用的方法有:增加溶质;蒸发溶剂;故答案为:增加溶质、蒸发溶剂;
(5)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是:b>a>c,升温后,a、b的质量分数不变,c的质量分数减小;故答案为:C;
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.

| A. | 电视机着火时用水浇灭 | |
| B. | 进入久未开启的菜窖用手电筒照明 | |
| C. | 用钢丝刷擦洗铝锅上的污垢 | |
| D. | 厨房天然气泄漏,立即关闭阀门并轻轻开窗通风 |
探究一:检验红色固体产物的成份
【查阅资料】Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;
Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】
假设1:红色固体只含Cu; 假设2:红色固体只含Cu2O;
假设3:红色固体为Cu和Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
该化学兴趣小组经交流讨论后,设计了如下方案:
【方案】称取5.00g的红色固体,用如下图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
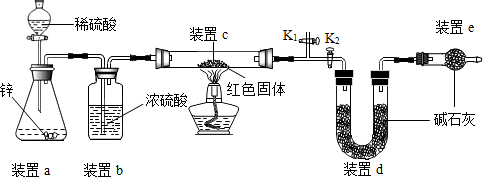
(1)装置a中用稀硫酸而不用稀盐酸,原因是稀盐酸有挥发性,干扰实验;
(2)装置b的作用是吸收水蒸气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中的二氧化碳和水蒸气进入d装置,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;
②检查装置气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防止发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行验纯;
④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的质量分数(写出计算过程,最后结果保留小数点后1位);
【交流与反思】
方案中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.
| A. | 用灼烧法鉴别羊毛和化纤 | |
| B. | 用肥皂水鉴别硬水和软水 | |
| C. | 加熟石灰粉末研磨,区分氯化铵和硫酸铵 | |
| D. | 用紫甘蓝和酒精溶液制酸碱指示剂 |
 实验小组用右图所示装置进行实验.已知:2NaOH+SO2═Na2SO3+H2O
实验小组用右图所示装置进行实验.已知:2NaOH+SO2═Na2SO3+H2O①关闭K,打开甲的胶塞,点燃硫粉后迅速塞紧胶塞.
②冷却至常温,将胶头滴管中的足量NaOH溶液挤入瓶中,振荡,使反应充分.
③打开K,观察乙中的现象.
下列说法不正确的是( )
| A. | 步骤①中,硫燃烧呈淡蓝色火焰,瓶内气压减小 | |
| B. | 步骤②中,甲装置内的气压减小,至与大气压相等 | |
| C. | 步骤③中,乙中的长导管口处冒气泡 | |
| D. | 步骤③中,甲装置内的气压增大,至与大气压相等 |
 如图是配制好的稀盐酸的标签,请根据标签上的文字信息,进行计算:
如图是配制好的稀盐酸的标签,请根据标签上的文字信息,进行计算: 南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚.
南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚.