题目内容
10.为测定某赤铁矿石中氧化铁的质量分数.Ⅰ.取一定量赤铁矿粉末与过量的碳粉混合,用下图装置进行操作测定(杂质始终不变)

(1)实验中持续通入干燥氮气.加热前缓缓通入氮气一段时间,其作用是排出装置中的二氧化碳.
(2)停止加热前是否需要先断开a和b连接以防止倒吸?为什么?不需要,因为反应结束后应该一直通入氮气直至试管冷却.
(3)如果氢氧化钠溶液对二氧化碳吸收是完全的,那么用氢氧化钠溶液质量变化测定得到的氧化铁质量分数将偏小(选填“偏大”“偏小”),原因可能是AB(填字母序号).
A.碳和氧化铁反应可能生成CO B.氮气在排出时可能带出水蒸气 C.b装置吸收右侧空气中CO2
Ⅱ.取该赤铁矿石样品10g,加入稀盐酸,恰好完全反应共用去稀盐酸100g,过滤得到滤渣2g(杂质既不溶于水也不溶于酸).计算赤铁矿中氧化铁的质量分数和所用盐酸中溶质的质量分数.
分析 氢氧化钠溶液能够吸收二氧化碳,并且能和二氧化碳反应生成碳酸钠和水;
碳在高温条件下和氧化铁反应时可能生成二氧化碳,也可能生成一氧化碳,也可能生成二氧化碳和一氧化碳;
氧化铁和稀盐酸反应生成氯化铁和水,根据滤渣质量可以计算氧化铁的质量,进一步可以计算计算赤铁矿中氧化铁的质量分数和所用盐酸中溶质的质量分数.
解答 解:(1)实验中持续通入干燥氮气.加热前缓缓通入氮气一段时间,其作用是排出装置中的二氧化碳.
故填:排出装置中的二氧化碳.
(2)因为反应结束后应该一直通入氮气直至试管冷却,所以停止加热前不需要先断开a和b的连接.
故填:不需要,因为反应结束后应该一直通入氮气直至试管冷却.
(3)A.碳和氧化铁反应可能生成CO,从而导致生成二氧化碳的质量偏小,进一步导致测定的氧化铁质量分数偏小;
B.氮气在排出时可能带出水蒸气,从而导致计算的二氧化碳质量偏小,进一步导致测定的氧化铁质量分数偏小;
C.b装置吸收右侧空气中的二氧化碳时,会导致计算的二氧化碳质量偏答,进一步导致测定的氧化铁质量分数偏大.
故填:偏小;AB.
设稀盐酸中氯化氢的质量为x,
氧化铁的质量为:10g-2g=8g,
Fe2O3+6HCl═2FeCl3+3H2O,
160 219
8g x
$\frac{160}{8g}$=$\frac{219}{x}$,
x=10.95g,
赤铁矿中氧化铁的质量分数为:$\frac{8g}{10g}$×100%=80%,
所用盐酸中溶质的质量分数为:$\frac{10.95g}{100g}$×100%=10.95%,
答:赤铁矿中氧化铁的质量分数为80%,所用盐酸中溶质的质量分数为10.95%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

 阅读快车系列答案
阅读快车系列答案| A. | 聚乙烯和聚氯乙烯都可以包装食品 | |
| B. | 红磷在空气中燃烧产生大量的白烟 | |
| C. | 普通玻璃和有机玻璃都属于无机非金属材料 | |
| D. | 铁加入稀硫酸中得到黄色溶液 |
探究一:检验红色固体产物的成份
【查阅资料】Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;
Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】
假设1:红色固体只含Cu; 假设2:红色固体只含Cu2O;
假设3:红色固体为Cu和Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
该化学兴趣小组经交流讨论后,设计了如下方案:
【方案】称取5.00g的红色固体,用如下图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
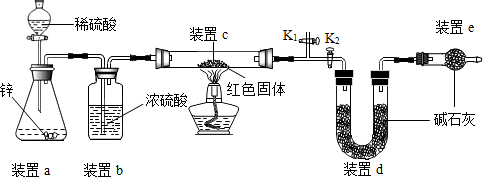
(1)装置a中用稀硫酸而不用稀盐酸,原因是稀盐酸有挥发性,干扰实验;
(2)装置b的作用是吸收水蒸气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中的二氧化碳和水蒸气进入d装置,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;
②检查装置气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防止发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行验纯;
④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的质量分数(写出计算过程,最后结果保留小数点后1位);
【交流与反思】
方案中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.
 通过化学学习,同学们对物质的组成、结构、性质及用途有了一定的了解.
通过化学学习,同学们对物质的组成、结构、性质及用途有了一定的了解.(1)请从C、H、N、O四种元素中选择一种或几种元素,写出符合下列要求的化学式.
①空气中含量最多的气体N2 ②用于炼铁的气体CO
③最常用的溶剂H2O ④能做消毒剂的有机物H2O2
(2)右图是某种燃气热水器的示意图.
①某热水器是以天然气为燃气,天然气的主要成分
是CH4,当“空气进气孔”被部分堵塞,燃
烧时容易产生有毒气体 M,M的化学式为CO.
②1kg不同燃料燃烧产生CO2和SO2的质量如表.根据数据可知,污染最少的燃料是天然气,燃烧生成的SO2容易产生的环境问题是酸雨.
| 燃料 | 相关燃烧产物的质量/g | |
| CO2 | SO2 | |
| 汽油 | 2900 | 5.0 |
| 天然气 | 2500 | 0.1 |
| 煤 | 2500 | 11.0 |

(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外,写出发生的其他一个化学反应方程式:Fe+H2SO4=FeSO4+H2↑或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)在实验室中操作A是过滤;
(3)滤液M经过操作B可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |
| 析出 晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | ||||||||
(4)在化学反应中,将有元素化合价变化的反应定义为氧化还原反应.在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它氧化物,试写出该氧化还原反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3.
| 编号 | 实验事实 | 实验结论 |
| A | 把燃着的木条伸入盛有某无色气体的集气瓶中,火焰熄灭 | 该气体一定是二氧化碳 |
| B | 向某无色溶液滴入无色酚酞溶液,呈红色 | 该溶液一定是碱溶液 |
| C | 向某物质中加入稀盐酸,产生气泡 | 该物质一定是碳酸盐 |
| D | 常温下,测得某溶液的pH=0 | 该溶液一定显酸性 |
| A. | A | B. | B | C. | C | D. | D |

 如图是明明同学将浑浊的河水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿,进行过滤的操作.
如图是明明同学将浑浊的河水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿,进行过滤的操作. 南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚.
南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚.