题目内容
5.下列物质溶解于水时,溶液的温度无明显变化的是CA、氢氧化钠固体 B、硝酸铵晶体 C、蔗糖 D、NaCl等.
分析 物质溶于水分为两个过程:构成物质的微粒向水中扩散的过程,这一过程需吸热,构成物质的微粒与水分子形成水和分子的过程,这一过程需放热,如果吸热大于放热则溶于水表现为吸热,如果吸热小于放热则溶于水表现为放热,如果吸热等于放热则表现为溶于水温度不变.
解答 解:常见的溶于水放热的有:浓硫酸、生石灰、氢氧化钠固体.常见吸热的有:硝酸铵.所以物质溶解于水时,溶液的温度无明显变化的是硝酸钾,氯化钠、氯化钾等物质.
故答案为:C;NaCl等.
点评 要了解物质溶于水的过程,知道为什么放热和吸热,记住溶于水吸热和放热的常见物质.

练习册系列答案
相关题目
15.已知木炭还原氧化铜实验中发生的主要反应:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,某化学兴趣小组对该实验红色固体产物的成份(假设反应物已完全反应)作如下探究:
探究一:检验红色固体产物的成份
【查阅资料】Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;
Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】
假设1:红色固体只含Cu; 假设2:红色固体只含Cu2O;
假设3:红色固体为Cu和Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
探究二:测定该实验红色固体产物中Cu2O的含量
该化学兴趣小组经交流讨论后,设计了如下方案:
【方案】称取5.00g的红色固体,用如下图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
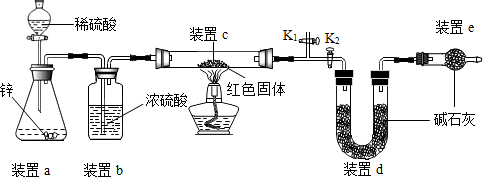
(1)装置a中用稀硫酸而不用稀盐酸,原因是稀盐酸有挥发性,干扰实验;
(2)装置b的作用是吸收水蒸气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中的二氧化碳和水蒸气进入d装置,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;
②检查装置气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防止发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行验纯;
④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的质量分数(写出计算过程,最后结果保留小数点后1位);
【交流与反思】
方案中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.
探究一:检验红色固体产物的成份
【查阅资料】Ⅰ.木炭还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的红色固体;
Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出问题】该实验的红色固体产物中含有什么物质?
【猜想与假设】
假设1:红色固体只含Cu; 假设2:红色固体只含Cu2O;
假设3:红色固体为Cu和Cu2O的混合物(请补充完成假设3).
【实验探究】(填写表中空格)
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
该化学兴趣小组经交流讨论后,设计了如下方案:
【方案】称取5.00g的红色固体,用如下图所示装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.

(1)装置a中用稀硫酸而不用稀盐酸,原因是稀盐酸有挥发性,干扰实验;
(2)装置b的作用是吸收水蒸气,若不加装置b,实验结果会偏大(“偏大”或“偏小”);
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)装置e的作用是防止空气中的二氧化碳和水蒸气进入d装置,若不加装置e,实验结果会偏大(“偏大”或“偏小”);
(5)点燃酒精灯前涉及的部分操作如下,
①连接仪器;
②检查装置气密性;
③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防止发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行验纯;
④打开K2,关闭K1
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,计算产物中Cu2O的质量分数(写出计算过程,最后结果保留小数点后1位);
【交流与反思】
方案中利用同样的装置,还可通过测定反应前后装置c(填“a”、“b”或“c”)的质量达到实验目的.
16.下列说法正确的是( )
| A. | NaC1、K2SO4、Ba(No3)2在水中能大量共存 | |
| B. | 用水可以区分硝酸铵和氢氧化钠两种固体 | |
| C. | 除去稀HCl中少量的H2SO4,可以滴加适量的硝酸钡溶液,然后过滤 | |
| D. | 铜丝在空气中加热后质量会增加,该反应不遵守质量守恒定律 |
13. 实验小组用右图所示装置进行实验.已知:2NaOH+SO2═Na2SO3+H2O
实验小组用右图所示装置进行实验.已知:2NaOH+SO2═Na2SO3+H2O
①关闭K,打开甲的胶塞,点燃硫粉后迅速塞紧胶塞.
②冷却至常温,将胶头滴管中的足量NaOH溶液挤入瓶中,振荡,使反应充分.
③打开K,观察乙中的现象.
下列说法不正确的是( )
 实验小组用右图所示装置进行实验.已知:2NaOH+SO2═Na2SO3+H2O
实验小组用右图所示装置进行实验.已知:2NaOH+SO2═Na2SO3+H2O①关闭K,打开甲的胶塞,点燃硫粉后迅速塞紧胶塞.
②冷却至常温,将胶头滴管中的足量NaOH溶液挤入瓶中,振荡,使反应充分.
③打开K,观察乙中的现象.
下列说法不正确的是( )
| A. | 步骤①中,硫燃烧呈淡蓝色火焰,瓶内气压减小 | |
| B. | 步骤②中,甲装置内的气压减小,至与大气压相等 | |
| C. | 步骤③中,乙中的长导管口处冒气泡 | |
| D. | 步骤③中,甲装置内的气压增大,至与大气压相等 |
20.科学探究中常用到推理的方法,根据下列事实推出结论正确的是( )
| 编号 | 实验事实 | 实验结论 |
| A | 把燃着的木条伸入盛有某无色气体的集气瓶中,火焰熄灭 | 该气体一定是二氧化碳 |
| B | 向某无色溶液滴入无色酚酞溶液,呈红色 | 该溶液一定是碱溶液 |
| C | 向某物质中加入稀盐酸,产生气泡 | 该物质一定是碳酸盐 |
| D | 常温下,测得某溶液的pH=0 | 该溶液一定显酸性 |
| A. | A | B. | B | C. | C | D. | D |
