80.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷线路板。请回答下列问题。
(1)检验溶液中Fe3+存在的试剂是: ,现象:
。
方程式: 。
请根据该反应设计一个原电池。在方框
中画出简装置图。(标出电极名称、电极
材料、电解质溶液)
(3)某工程师为了从使用过的腐蚀废液中回
收铜,并重新获得纯净的FeCl3溶液,准
备采用下列步骤:
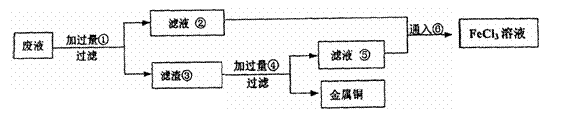
A:请写出上述实验中有关物质的化学式:
② ③ ⑥
B:请写出上述实验中相关反应的离子方程式:
77.某学生想把AlCl3溶液和Na2S溶液混合制取Al2S3,但最后得到一种白色胶状沉淀,而且混合液中有臭鸡蛋气味的气体放出,造成此结果的原因是(用离子方程式表示)____________________________________ __________________ ,制取Al2S3的正确方法是(用化学方程式表示) ___________________________________________
 78.氯化铜晶体中常含FeC1杂质,为制得纯净氯化铜晶体(CuC12·2H2O),首先将其溶于稀盐酸中,然后按下面所示操作步骤进行提纯。
78.氯化铜晶体中常含FeC1杂质,为制得纯净氯化铜晶体(CuC12·2H2O),首先将其溶于稀盐酸中,然后按下面所示操作步骤进行提纯。
已知:
|
|
氢氧化物开始沉淀时的pH |
氯氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Cu2+ |
4.7 |
6.7 |
(1)下列物质中,最适合作为氧化剂X的是 (填序号)
A.H2O2 B.KMnO4 C.NaC1O D.浓硫酸
写出加入X后发生反应离子的方程式 。
(2)加入的物质Y可以是 ,目的是
。
|
|||
(3)某同学利用反应Cu+2H+ Cu2++H2↑
设计实验来制取氯化铜溶液。该同学设计
的装置应该为 。(填“原电
池”或“电解池”)。请在右侧方框中画出
该同学设计的装置图,并指明电极材料和
电解质溶液。
(4)从CuC12稀溶液中得到CuC12·2H2O晶体,在蒸发结晶的过程中,为了防止Cu2+的水解,应采取的措施是 。
75.类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编号为AB,然后通过实验确定其成分探究过程如下:
(1)提出假设:A是FeCl3,B是FeCl2
(2)设计实验方案:分别取AB的溶液均进行以下实验,但实验现象相同请填写下表中的相应空格
|
实验方法 |
实验现象 |
结论 |
|
分别向AB溶液中加 KSCN溶液 |
|
固体物质中有FeCl3 |
|
分别向KMnO2溶液中 加适量AB溶液 |
KMnO2溶液颜色无明显变化 |
固体物质中不含______ |
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式:
___________________________________________________。
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是_____________(填写序号)
A.将A溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有FeCl3 FeCl3CuCl2,某研究性学习小组的同学们设计了两种从废液中回收Cu的方案:_________________________。
方案1:向废液中加入过量的铁粉,充分反应后,过滤在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜该方案中涉及的四种阳离子的氧化性由强到弱的顺序为:
______________________________________。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解当观察到阴极上少量气泡产生时,即停止电解,这时要回收的Cu已全部析出该方案中铜作________极。所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)___________________________________________。
方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:
___________________________________________。
71.学习元素周期律后,某研究性学习小组的同学们对第四周期过渡元素的氧化物产生了浓厚的兴趣。在已知二氧化锰对氯酸钾催化分解知识的基础上,联想到氧化铁、氧化铜、氧化铬等对氯酸钾的分解是否有催化作用,对此他们进行了实验研究。
请根据要求完成下列部分实验报告:
(1)课题名称: 。
(2)实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、 等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
(3)实验步骤:略
(4)实验数据:
|
实验 编号 |
KC1O3/g |
氧化物 |
产生气体/mL (已折算到标况) |
耗时/s |
||
|
化学式 |
质量/g |
回收 |
||||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
90% |
67.2 |
188.3 |
(5)实验讨论:
①在氧化物的回放过程中,要进行的操作是溶解、 、洗涤、 、称量。
②实验编号3的实验中KC1O3的分解率为 (保留一位小数)。
③在和Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气味的气体是 ,可用 试纸检验。上述异常现象产生的原因是 。
(6)实验结论 。
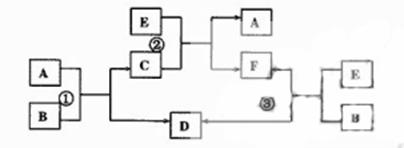
 (1)写出B的电子式:
。
(1)写出B的电子式:
。

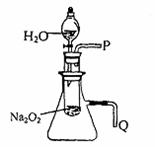 第二,
。
第二,
。 (4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中是否含有H2O2,其实验方法为:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论:
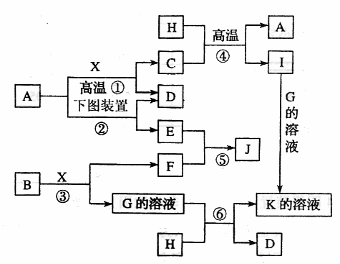
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中是否含有H2O2,其实验方法为:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论: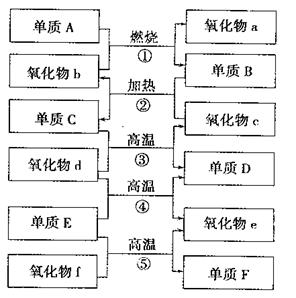 73.右图是部分化学常见的氧化物和单质的转化关系。其中。气化物f是制造光导纤维的重要原料,氧化物c是一种具有磁性的黑色物质。回答下列问题:
73.右图是部分化学常见的氧化物和单质的转化关系。其中。气化物f是制造光导纤维的重要原料,氧化物c是一种具有磁性的黑色物质。回答下列问题: