23. 海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
 (1)在光照条件下,氯气和氢气反应过程如下:
(1)在光照条件下,氯气和氢气反应过程如下:
 ① Cl2¾®Cl+Cl ② Cl+H2¾®HCl+H ③ H+Cl2¾®HCl+Cl ……
① Cl2¾®Cl+Cl ② Cl+H2¾®HCl+H ③ H+Cl2¾®HCl+Cl ……
 反应 ② 中形成的化合物的电子式为__________;反应③中被破坏的化学键属
反应 ② 中形成的化合物的电子式为__________;反应③中被破坏的化学键属 于_______键(填:极性、非极性)。
于_______键(填:极性、非极性)。
 (2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是______(
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是______( 用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第_____周期_____族。
用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第_____周期_____族。
 (3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是_____
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是_____
 a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
 b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小
b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小

|

 c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 250
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 250



 d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
 (4)卤素单质的键能大小如右图。由图推断:
100
(4)卤素单质的键能大小如右图。由图推断:
100
 ① 非金属性强的卤素,其单质分子的化学键__________ 50
① 非金属性强的卤素,其单质分子的化学键__________ 50
 断裂(填:容易、不容易、不一定容易)。
F-F Cl-Cl Br-Br I-I
断裂(填:容易、不容易、不一定容易)。
F-F Cl-Cl Br-Br I-I
 ② 卤素单质键能大小与键长的关系为:_________________________________________
② 卤素单质键能大小与键长的关系为:_________________________________________
25.(B)元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
单质制成的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 |
单质常温、常压下是气体,原子的L层有一个未成对的p电子。 |
+2价阳离子的核外电子排布与氖原子相同。 |
(1)上表中与A属于同一周期的元素是_____,写出D离子的电子排布式__________
(2)D和C形成的化合物属于_____晶体。
写出C单质与水反应的化学方程式_____________________________________________
(3)对元素B的单质或化合物描述正确的是_____
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下镁条能与单质B反应
(4)A和D量元素金属性较强的是(写元素符号)_____。写出能证明该结论的一个实验事实 _____________________
2009年
25.(A)四种短周期元素的性质或结构信息如下表。氢根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
室温下单质呈粉末状固体,加热易熔化。 单质在空气中燃烧,发出明亮的蓝紫色火焰。 |
单质常温、常压下是气体,能溶于水。 原子的M层有1个未成对的p电子。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
原子最外层电子层上s电子数等于p电子数。 单质为空间网状晶体,具有很高的熔、沸点。 |
(1)B元素在周期表中的位置_______________,写出A原子的电子排布式__________
(2)写出C单质与水反应的化学方程式_________________________________________
A与C形成的化合物溶于水后,溶液的pH_____7(填:大于、等于、小于)。
(3)D元素最高价氧化物晶体的硬度_____(填:大、小),其理由是____________
(4)A、B两元素非金属性较强的是(写元素符号)_____。写出证明这一结论的一个实验事实________________________________________
24.在2 L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
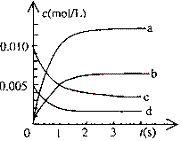 (1)写出该反应的平衡常数表达式:K=__________
(1)写出该反应的平衡常数表达式:K=__________
已知:K300℃>K350℃,则该改反应是_____热反应。
(2)右图中表示NO2的变化的曲线是_____
用O2表示从0~2s内该反应的平均速率v=__________
(3)能说明该反应已达到平衡状态的是_____
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂

 2Fe+3CO2(g)
2Fe+3CO2(g)

 v
v
v
v
v
v
v
v



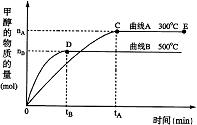 根据题意完成下列各题:
根据题意完成下列各题: