摘要:6.在温度.容积相同的3个密闭容器中.按不同方式投入反应物.保持恒温.恒容.测得反应达到平衡时的有关数据如下w w w. k#s5 (已知 kJ·mol): 容器 甲 乙 丙 反应物投入量 1mol N2.3mol H2 2mol NH3 4mol NH3 NH3的浓度(mol·L) c1 c2 c3 反应的能量变化 放出akJ 吸收bkJ 吸收ckJ 体系压强(Pa) p1 p2 p3 反应物转化率 下列说法正确的是 A. B. C. D. 解析:本题主要考查的是化学平衡和反应热的有关知识.在等温等容时.若起始物质的量不同.则转化率也不同.也不成倍数关系.应该是2 c1<c3.A错误,B项.实际上为等效平衡.不同的是反应的起始方向不同.因此过程中乙吸收的热热量相当于过程甲甲完全转化需再放出的热量.故a+b=92.4.B正确,C项.根据平衡的建立过程.通过模拟中间状态分析.丙的转化率小于乙.故2p2>p3.C错误,因为甲.乙两过程属于等效平衡.所以a1+a2=1.而a2> a3,所以a1+ a3<1.综上分析可知.本题选BD项. 答案:BDw w w. k#s5
网址:http://m.1010jiajiao.com/timu3_id_67568[举报]
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:(已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1)
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系的压强(Pa) | p1 | p2 | p3 |
| 反应物的转化率 | a1 | a2 | a3 |
| A、2c1>c3 |
| B、a+b=92.4 |
| C、2p2<p3 |
| D、α1+α3=1 |
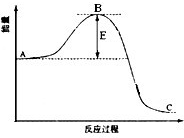 合成氨反应过程中的能量变化如图所示,据图回答下列问题:
合成氨反应过程中的能量变化如图所示,据图回答下列问题:(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点
降低
降低
(填升高、降低或不变),理由是因为催化剂改变了反应的历程使活化能E降低
因为催化剂改变了反应的历程使活化能E降低
;(2)该反应平衡常数表达式为:K=
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
<
<
K(填“<”、“>”或“=”)时,反应向右进行.(3)450℃时该反应的平衡常数
>
>
500℃时的平衡常数(填“<”、“>”或“=”).(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的措施是
ce
ce
(填字母代号).a.高温高压 b.加入催化剂 c.增加N2的浓度
d.增加H2的浓度 e.分离出NH3
(5)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应物转化率 | a1 | a2 | a3 |
BC
BC
.A.c1<c2 B.2c1<c3 C.a1+a2=1 D. a2<a3.
 (2011?郑州二模)利用所学化学反应原理,解决以下问题:
(2011?郑州二模)利用所学化学反应原理,解决以下问题:(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、N
| H | + 4 |
| H | + 4 |
NH4Cl和NH3?H2O
NH4Cl和NH3?H2O
.(2)0.1mol?L-1的氨水与0.05mol?L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:
NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是
R2Z>RX>RY
R2Z>RX>RY
.(4)以石墨电极电解100mL 0.1mol?L-1CuSO4溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为
0.64
0.64
g.(5)向20mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)=
0.2
0.2
mol?L-1.(6)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H2(g)+
I2(g)?2HI(g)△H=-14.9kJ?mol-1),在恒温、恒容条件下,测得反应达
到平衡时的数据如下表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2、1mol I2 | 2 mol HI | 4 mol HI |
| HI的浓度(mol?L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 反应物转化率 | a1 | a2 | a3 |
AC
AC
.A.α1+α2=1 B.2α2=α3 C.a+b=14.9 D.c1=c2=c3.
在温度,容积相同的3个密闭容器中,按不同方式投入反应物,在保持恒温、恒容条件下发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,测得相关数据如下表:
|
查看习题详情和答案>>
 生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.
生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.(1)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质.当两者1:1催化反应,其原子利用率达100%,合成的物质可能是
cd
cd
.a.汽油 b.甲醇 c.甲醛 d.乙酸
(2)甲醇是一种重要的化工原料,工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ?mol-1.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
ac
ac
.a.c1=c2 b.2Q1=Q3 c.K1=K3 d.α2+α3<100%
(3)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)

①若一体积可变的密闭容器中充入3mol H2、3mol CO、1mol CH3OCH3、1mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.则:反应开始时:v(正)>v(逆)的理由是:
反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小,平衡正移
反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小,平衡正移
.平衡时,n(CH3OCH3)=
1.75
1.75
mol.②右图为绿色电源“二甲醚燃料电池”的工作原理示意图.b电极是
正
正
极(填“正”或“负”);a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+
(CH3)2O-12e-+3H2O=2CO2+12H+
.