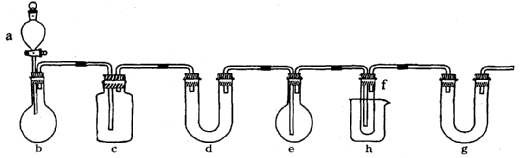
4.(15分)PCL3有毒,在潮湿的空气中可发生水解反应产生大量的白雾。它在实验室和工业上都有重要的应用。在实验室中可用下图所示装置(酒精灯、铁架台等未画出)制取PCL3,在圆底烧瓶e中放入足量白磷,将CL2迅速而有不间断地通入e中,氯气与白磷会发生反应,产生火焰。

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
三氯化磷和五氯化磷的物理常数如下:
|
|
熔点 |
沸点 |
|
三氯化磷 |
-112℃ |
76℃ |
|
五氯化磷 |
148℃ |
200℃分解 |
图中a、b应该装入的试剂或药品分别是浓盐酸和二氧化锰,并在b仪器处加热。请据此回答下列问题:

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
(1)写出b中发生反应的化学方程式:____________________________________。
(2)氯气和白磷反应放出大量的热,为使仪器e不致因局部过热而炸裂,实验开始前应在e的底部放少量_______________________。
(3)在烧杯h中加入冰盐水,其作用是_________________________________。
(4)C中所盛装的试剂是_______,其作用是_______________________________。
(5)实验室将白磷保存于水中,取出的白磷用滤纸初步吸去表面水分,然后浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。已知酒精与乙醚互溶,乙醚易挥发。用上述方法除去水分的原因是___________________________
______________________________。
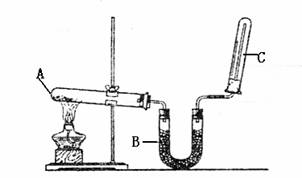
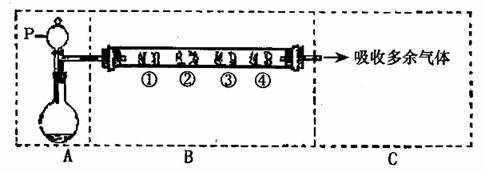
1.(16分)用右图装置,进行硝酸与铜片反
应的实验,同时,为了防止污染,在试管
B里盛B里盛放足量氢氧化钠溶液,以吸
收反应产生的气体。
(1)实验前如何检查该装置的气密性
。
(2)若实验使用的试剂是质量分数为63%的硝酸和小铜片,操作中怎样加入硝酸和铜
片才能避免铜片与硝酸刚一接触时生成的气体外逸到空气中 。
。
该反应中可能会出现哪些实验现象
。
(3)若使用的试剂是1mol·L-1的硝酸和小铜片,则A试管中所发生反应的化学方程
式是 ,实验
结束后试管B中的溶液所含的溶质有(写化学式)
。
(4)为了从上述实验中获得纯净的NO,拟用以下装置除去NO中的杂质,将试管A
与下图C、D装置相连,最好选用表中的 方法(填编号),理由是 。
|
 2.(18分)实验室用右图所示装置制取干燥的氨气
2.(18分)实验室用右图所示装置制取干燥的氨气

 高☆考♂资♀源?网 ☆
高☆考♂资♀源?网 ☆
(1)写出A处所发生反应的化学方程式 ,
(2)B装置的作用是 B装置内所盛药品的名称为 。
(3)若以a1、a2分别表示浓度为Xmol/L和Ymol/L的氨水的质量分数,且知X=2Y
则这两种氨水质量分数的关系为 (氨水的密度比水小)
A.a1=2a2 B.2a2>a1 C.a1>2a2 D.无法确定
(4)如何检验氨气是否收集满 ,
(5)有位同学只用了一个圆底烧瓶、带玻璃管的橡皮塞、胶管、止水夹、酒精灯、少量浓氨水,大烧杯及水即做成了喷泉实验,制备氨气时,他是怎么操作的 ,
简述原理 。
 ·
·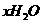 )中结晶水x值的实验过程中:称量操作至少进行
)中结晶水x值的实验过程中:称量操作至少进行 

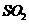 气体,并通
气体,并通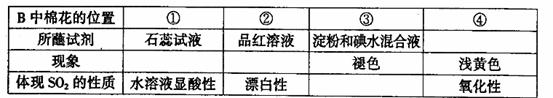
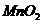 b.
b.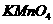 c.KCl d.Cu
c.KCl d.Cu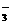 ,写出该反应的离子方程式:
,写出该反应的离子方程式: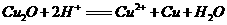 );②在空气中灼烧
);②在空气中灼烧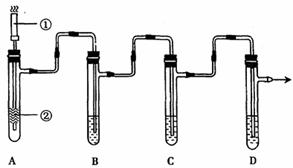
 有_______种。
有_______种。 血红蛋白-O2+CO 血红蛋白-CO+O2
血红蛋白-O2+CO 血红蛋白-CO+O2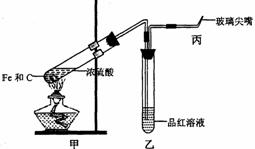 (3)某同学为研究硫酸的性质,设计了以下实验。检查好装置的气密性后,在甲的试管中加入足量的Fe和C,然后,加入少量浓硫酸。
(3)某同学为研究硫酸的性质,设计了以下实验。检查好装置的气密性后,在甲的试管中加入足量的Fe和C,然后,加入少量浓硫酸。

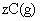
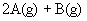
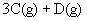
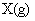
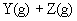 使反应达到平衡,这时容器中混合气体中X气体体积分数是a%。若在同一容器中,最初放入的是1mol Y和1mol Z的混合气体,并在相同的温度下使反应达到平衡,这时混合气体中X气体所占的体积分数是b%。则a和b的关系是(
)
使反应达到平衡,这时容器中混合气体中X气体体积分数是a%。若在同一容器中,最初放入的是1mol Y和1mol Z的混合气体,并在相同的温度下使反应达到平衡,这时混合气体中X气体所占的体积分数是b%。则a和b的关系是(
)