1、以考察原理为主的综合试题
化学实验原理是高中化学比较难的内容,本身学生在学习这部分内容时就很难融合会贯通,以实验题为载体,重点考察化学原理就显得难上加难。从题目分析,仍有规律可循。
例1、(09广东化学22)(12分)
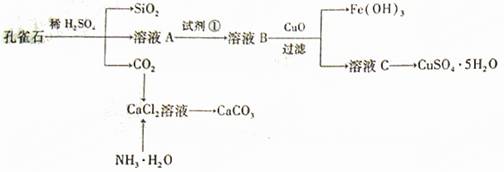
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
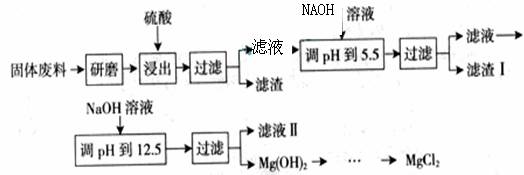
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
PH |
3.2 |
5.2 |
12.4 |
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(2)滤渣I的主要成分有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
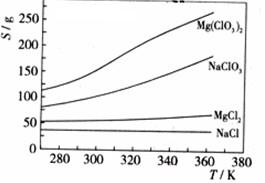
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
答案:
(1)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)
(2)Fe(OH)3 Al(OH)3
(3)Na2SO4
(4)①在某一时NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大;NaCl 的溶解度与其他物质的溶解度有一定的差别。
②降温前溶液中NaCl以达饱和;降低过程中NaCl溶解度会降低 ,会少量析出。重结晶。
解析:
浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率。硫酸浸出液经过滤,滤液中主要溶质是MgSO4、Al2(SO4)3和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣I的主要成分是Fe(OH)3 Al(OH)3,此时滤液中阴离子主要是SO42-,加入NaOH后Mg2+完全沉淀,溶质主要成分是Na2SO4;反应MgCl2+2NaClO3===Mg(ClO3)2+2NaCl类似于侯德榜制碱法生成NaHCO3的原理,因为NaCl溶解度小而从溶液中析出,使反应向生成Mg(ClO3)2的方向进行;同样是依据①的原理,在降温的过程中,Mg(ClO3)2的溶解度不断减小,从溶液中析出,在生成Mg(ClO3)2的过程中NaCl也不断生成,但因溶解度没有增加,所以也伴随Mg(ClO3)2析出;相同温度时氯化钠的溶解度最小,因此在冷却降温析出Mg(ClO3)2过程中一定会析出氯化钠。由于氯酸镁和氯化钠均溶于水,溶于水的可溶性物质一般用结晶和重结晶的方法分离。
总结:本题以提取镁为背景,考察化学反应速率,溶解度等相关内容,明确了考察考察内容,就容易入手。
变式训练:
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
⑴在ClO2的制备方法中,有下列两种制备方法:
方法一:NaClO3+4HCl=2ClO2↑+Cl2↑+NaCl+2H2O
方法二:2NaClO3+H2O 2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是 。
⑵用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。2001年我国卫生部规定,饮用水中的ClO2-含量应不超过0.2 mg·L-1。
饮用水中的ClO2、ClO2-含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。当pH≤2 .0时,ClO2-也能被I-完全还原为Cl-。反应生成的I2用标准Na2S2O3溶液滴定;2 Na2S2O3+ I2=Na2S4O6+NaI
①请写出pH≤2 .0时ClO2-与I-反应的离子方程式 。
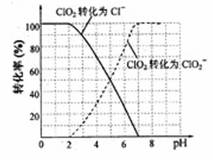
②请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根据上述分析数据,测得该饮用水中ClO2-的浓度为 mol·L-1(用含字母的代数式表示)。
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成为Cl-,该反应的氧化产物是 (填化学式)。
解析:该题是以“ClO2的制备及其在饮用水处理领域的应用”为背景二设计的化学综合探究题,引导学生关注化学在生活中的应用。第(1)问是对不同ClO2制备方法的评价,学生需从题干中提取到“Cl2用于饮用水处理会产生对人体有潜在危害的有机氯代物”的信息,通过分析形成结论;第(2)问以“用连续碘量法测定饮用水中ClO2和ClO2-含量”为线索,从离子方程式的书写、实验过程的设计、实验探究结果的表述等方面设置问题,学生只有经过对题给信息的分析,充分理解探究原理和过程,才能准确回答这些问题。该题考查了学生灵活运用所学知识解决实际问题的综合能力,特别是对学生信息素养(信息获取、处理、加工和输出)的考查,引导中学化学教学关注对学生信息素养的提升和解决问题能力的培养。
 (1)按顺序写出该过程中发生反应的离子方程式:
(1)按顺序写出该过程中发生反应的离子方程式: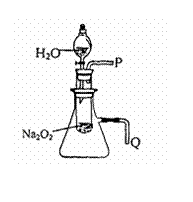 第二,
。
第二,
。 (4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中是否含有H2O2,其实验方法为:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论:
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中是否含有H2O2,其实验方法为:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论: