1.[南京市2009届高三化学考前专题]四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
⑴写出B原子的电子排布式 ▲ 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 ▲ (填“高”或“低”),其原因是 ▲ 。
⑶D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 ▲ (填“高”或“低”),其原因是 ▲ 。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ▲ ,简要描述该配合物中化学键的成键情况 ▲ 。
 ⑸下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,
⑸下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,
“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
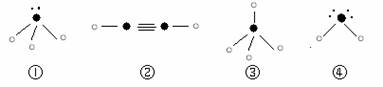
则在以上分子中,中心原子采用sp3杂化形成化学键的是 ▲ (填写序号);在②的分子中有 ▲ 个σ键和 ▲ 个π键。
1.[南京市2009届高三第一次调研测试]下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
|
Z |
|
|
|
|
|||||||||||||
|
|
|
M |
L |
Q |
R |
|
|
||||||||||
|
D |
A |
|
|
T |
X |
Y |
|
||||||||||
|
E |
|
|
|
|
|
|
|
|
J |
|
|
|
|
|
|
|
|
(1)Y分别与D、E形成的化合物中熔点较高是 ▲ (用化学式表示);T、X、Y原子的第一电离能由小到大的顺序是 ▲ (用元素符号表示)。
(2)LX2分子的电子式是 ▲ ,XY2分子是 ▲ (填“极性分子”或“非极性分子”);QY3分子中Q采用 ▲ 杂化。
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。则J原子的核外电子排布式是 ▲ (基态);与配体粒子互为等电子体的离子是 ▲ ;J(LR)4固态时属于 ▲ 晶体(填晶体类型)
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有多同分异构体(其中Q以三个单键与其它原子相连),写出其中沸点最低的物质结构简式 ▲ 。
(5)A与M组成的一种化AM2,刷新了金属化合物超导 温度的最高记录。右图中所示的是该化合物的晶体结构单元。图中上下底面中心“Δ”处的原子是 ▲ (填元素符号)。


 2.[盐城市伍佑中学2009年江苏高考化学押题卷]二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是[B]
2.[盐城市伍佑中学2009年江苏高考化学押题卷]二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是[B]
A.S2Cl2的电子式为
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:
2S2Cl2+2H2O=SO2↑+3S↓+4HCl