3.金属晶体与其它常见晶体的比较
|
晶体类型 |
离子晶体 |
原子晶体 |
分子晶体 |
金属晶体 |
|
|
实例 |
NaCl晶体 |
金刚石 |
干冰 |
镁 |
|
|
构成晶体的微粒 |
阴、阳离子 |
原子 |
分子 |
金属离子、自由电子 |
|
|
微粒间的相互作用 |
离子键 |
共价键 |
范得华力 |
金属键 |
|
|
物理性质 |
硬度 |
较大 |
很大 |
很小 |
较小 |
|
熔沸点 |
较高 |
很高 |
低、很低 |
多数较高 |
|
|
导电性 |
晶体不导电(熔化时或水溶液中导电) |
一般为非导体 |
非导体(有的水溶液能导电) |
良导体 |
|
项目 |
内容 |
|
|
周期表中的分布 |
位于从硼到砹的左下方,在已知的109种元素中有87种是金属元素 |
|
|
原子结构的特征(最外层电子) |
最外层电子数一般少于4个(ⅣA-ⅥA的某些金属元素有4-5个,但核外电子层数较多,原子半径较大) |
|
|
组成微粒 及通常状态 |
金属离子和自由电子 通常情况下都是金属晶体,只有汞在常温下呈液态 |
|
|
分类 |
冶金工业 |
黑色金属:铁、铬、锰 有色金属:除铁、铬、锰以外的金属 |
|
密度 |
轻金属:密度小于4.5g/cm3 重金属:密度大于4.5g/cm3 |
|
|
从与人的接触分 |
常见金属:如铁、铜、铝等 稀有金属:如锆、铪、铌等 |
|
|
物理性质(通性) |
有金属光泽、不透明,热和电的良导体,有良好的延性和展性 |
1.金属的晶体结构:
金属具有一些共同性质,是由它们的原子结构和晶体结构的相似性决定的。金属的价电子较少,容易失去价电子变成金属离子,这些释出的价电子,不在属于那个或那几个指定的金属离子,而是整体金属的“集体财富”。它们在整个晶体内自由移动,人称“自由电子”。有人描述金属晶体内的实际情况是“金属离子沉浸在自由电子的海洋中”。换言之,是金属离子和自由电子之间存在着较强的电性作用,使许多金属离子和自由电子相互结合在一起形成晶体。
但是金属晶体中的“金属离子和自由电子之间存在着较强的电性作用”有相对强弱之分。一般来说,价电子数越多,原子半径越小,“作用”愈强,其熔沸点相对较高,密度、硬度也相对较大。
例如:同一主族金属元素的原子,价电子数目相同,从上到下随原子序数的递增,电子层数增多,原子半径增大,金属晶体中金属阳离子与自由电子的作用逐渐减弱,因此,它们的熔点逐渐降低,硬度逐渐减小。如:碱金属熔点钠比钾高,硬度钠比钾大。
同一周期金属元素的原子的电子层数相同,从左到右随原子序数的递增,价电子数增多,原子半径减小,金属晶体中金属阳离子与自由电子的作用逐渐增强。因此它们的熔点逐渐升高,硬度逐渐增大。如:按钠、镁、铝的顺序熔点依次升高,硬度逐渐增大。
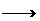 2FeO+CO2
2FeO+CO2