18.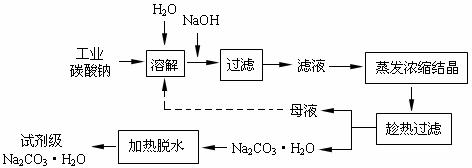 (12分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
(12分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:

Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
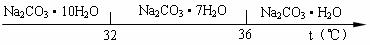
Ⅱ、25℃时有关物质的溶度积如下:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
 (1)加入NaOH溶液时发生的离子方程式为
。
(1)加入NaOH溶液时发生的离子方程式为
。
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“趁热过滤”时的温度应控制在 。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行 ,并说明理由 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+ 532.36kJ·mol-1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+ 473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
16.(10分)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以此废渣制备铁红(Fe2O3)的过程如下。此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见右表。
|
沉淀物 |
开始沉淀pH |
沉淀完全pH |
|
Al(OH)3 |
3.0 |
5.2 |
|
Fe(OH)3 |
1.5 |
2.8 |
|
Fe(OH)2 |
7.6 |
9.7 |
|
Mg(OH)2 |
8.0 |
12.4 |
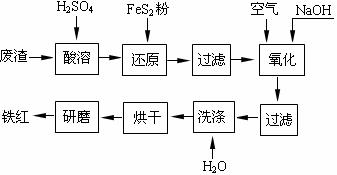
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式是 。
(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式: 。
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式: 。
(4)为了确保铁红的质量,氧化过程需要调节溶液pH的范围为 ≤pH< 。
(5)若NaOH加入过量,所的铁红产品中有其它杂质,但可能无Al2O3,其原因是(用离子方程式表示): 。
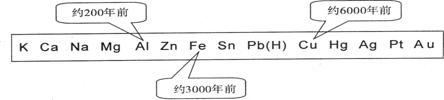 A.金属的化合价高低 B.金属的导电性强弱
C.金属的活动性大小 D.金属在地壳中的含量多少
A.金属的化合价高低 B.金属的导电性强弱
C.金属的活动性大小 D.金属在地壳中的含量多少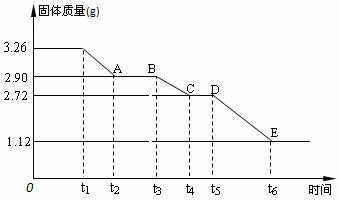
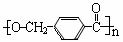 (14分)分子式为C8H10有机物A与氯气反应生成产物有多种,产物之一B可发生下列转化合成聚酯类高分子材料
,其合成路线如下:
(14分)分子式为C8H10有机物A与氯气反应生成产物有多种,产物之一B可发生下列转化合成聚酯类高分子材料
,其合成路线如下: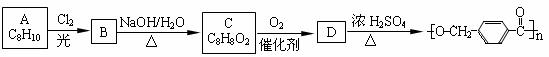
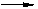 (1)A B的反应类型是 。
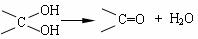
(1)A B的反应类型是 。 (4)格氏试剂在有机合成方面用途广泛,可用于卤代烃和镁在醚类溶剂中反应制得。设R为烃基,已知:
(4)格氏试剂在有机合成方面用途广泛,可用于卤代烃和镁在醚类溶剂中反应制得。设R为烃基,已知: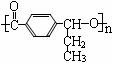
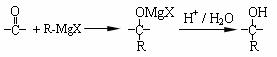
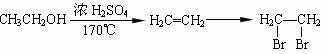
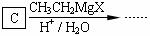
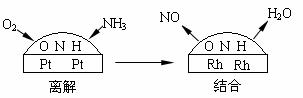
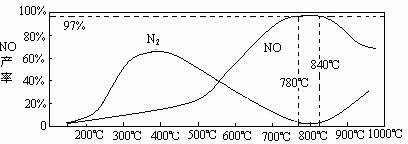
 4NO(g)+ 6H2O(g);△H=-905.5
kJ·mol-1 K1=1×1053 (900℃)
4NO(g)+ 6H2O(g);△H=-905.5
kJ·mol-1 K1=1×1053 (900℃) 2N2(g)
+ 6H2O(g);△H=-1267 kJ·mol-1 K3=1×1067
(900℃)
2N2(g)
+ 6H2O(g);△H=-1267 kJ·mol-1 K3=1×1067
(900℃) 5N2(g)+6H2O(g);△H=-1804 kJ·mol-1,还可能发生氨、一氧化氮的分解。
5N2(g)+6H2O(g);△H=-1804 kJ·mol-1,还可能发生氨、一氧化氮的分解。 N2(g)
+O2(g);△H=
。
N2(g)
+O2(g);△H=
。
 SO2(g)+1/2O2(g);△H= +98 kJ·mol-1。开始时在
SO2(g)+1/2O2(g);△H= +98 kJ·mol-1。开始时在 D.保持温度和容器内压强不变,充入1mol SO3
D.保持温度和容器内压强不变,充入1mol SO3