0 42491 42499 42505 42509 42515 42517 42521 42527 42529 42535 42541 42545 42547 42551 42557 42559 42565 42569 42571 42575 42577 42581 42583 42585 42586 42587 42589 42590 42591 42593 42595 42599 42601 42605 42607 42611 42617 42619 42625 42629 42631 42635 42641 42647 42649 42655 42659 42661 42667 42671 42677 42685 447348
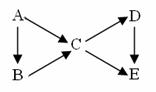 (1)若上图中B、C均为氧化物、D、E均为盐,则A可能是__________。
(1)若上图中B、C均为氧化物、D、E均为盐,则A可能是__________。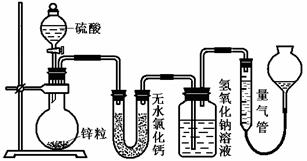 (1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ 。
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ 。