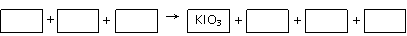31、某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):
2 Cu2S+3O2®2Cu2O+2 SO2 2Cu2O+Cu2S®6Cu+SO2
(1) 若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?(设杂质不参加反应)
(2) 若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?(保留3位小数)
(3) 今将a mol Cu2S与b mol空气(氧气约占空气体积的20%)在密闭容器中高温加热,设反应前容器内的压强为P1,反应结束后冷却到原来的温度,容器内的压强为P2,请完成下列表格:
|
反应后固体的成分 |
Cu |
Cu2S、Cu |
Cu2O、Cu |
|
b的取值范围 |
|
|
|
|
P1与P2的关系 (填>、<、=) |
P1 P2 |
P1 P2 |
P1 P2 |
25、煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
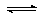 (1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
①写出该可逆反应的化学平衡常数表达式_________________________________
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的
是 。 (填字母,下同)
a.容器中的压强不再改变 b. 1 mol H-H键断裂的同时断裂2molH-O键
c.v正(CO) = v逆(H2O) d. c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
①实验1中以v(CO2) 表示的反应速率为 。
②该反应的逆反应为 (填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
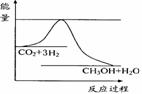 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量的变化。
在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使
c (CH3OH)增大的是________。
a.充入H2(g),使体系压强增大 b.降低温度
c.将H2O(g)从体系中分离出来 d.使用催化剂,加快反应
五:实验题(共24分)
23、A、B、M、X、Z是周期表中的短周期元素。对它们的单质或部分化合物描述如下:
|
A |
B |
M |
X |
Z |
|
最简氢化物是含氢量最高的有机物 |
单质为气体,元素原子中成对电子数比未成对电子数多一个 |
最简氢化物的水溶液呈酸性 |
原子核外有5种能量不同的电子,最外层有3个电子 |
最高价氧化物对应的水化物为最强酸 |
回答下列问题:
(1)B的最简氢化物的分子构型是 ____,A原子的最外层电子的轨道表示式为_______________;
(2)X在元素周期表中的位置为______周期____族,写出X的单质溶解在NaOH溶液中的
离子方程式为_______________________________;
(3)A、B两元素非金属性较强的是(写元素符号) 。写出证明这一结论的一个化学方程
式 ;
(4)与元素Z相比,元素M的最简氢化物稳定性 (选填“强”、“弱”),理由是____________________________________。
 2Mn2+ +10CO2↑+8H2O
2Mn2+ +10CO2↑+8H2O 
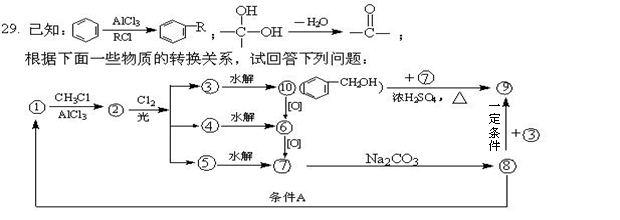 (1)化合物⑨的名称是_____________,反应条件A是________________________。
(1)化合物⑨的名称是_____________,反应条件A是________________________。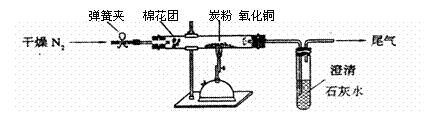
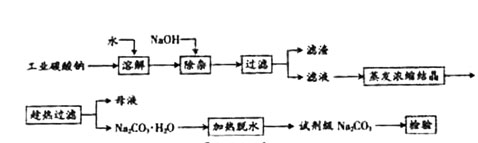 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO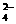 等杂质,提纯工艺路线如上:
等杂质,提纯工艺路线如上: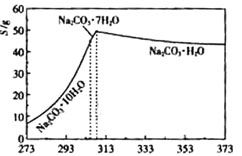 已知碳酸钠的溶解度(S)随温度变化的曲线如右图所示:
已知碳酸钠的溶解度(S)随温度变化的曲线如右图所示: