28. I.用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外不能选用其他试剂)。
I.用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外不能选用其他试剂)。
(1)正确的操作步骤是:
II.测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止 ⑦根据实验数据计算硫酸铜结晶水的含量。
请回答下列问题:
(2)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是 。
(3)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?
答: 。
(4)实验步骤⑥的目的是 。
(5)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号): 。
A.被测样品中含有加热不挥发的杂质 B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水 D.加热前所用的坩埚未完全干燥
|
程式为:
 2FeSO4·7H2O====Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验
2FeSO4·7H2O====Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验
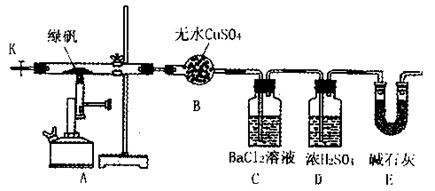
装置来验证绿矾受热分解是否发生上述反应。主要实验步骤如下:

①组装仪器并检查装置的气密性;
②称量绿矾样口及U型干燥管E的质量,将称量后的绿矾置于硬质玻璃管内;
③关闭活塞K,加强热使绿矾完全分解;
④打开活塞K,缓缓鼓入一定量的氮气;
⑤再次称量干燥管E的质量;
⑥重复④⑤的操作,直到干燥管E的质量基本不变为止;
⑦称量洗气瓶C中所得沉淀的质量。
试回答:
(1)洗气瓶D中浓H2SO4的作用为: ;
(2)步骤⑦从溶液中获取生成沉淀质量的具体操作为: ;
(3)实验小组的报告如下,请补充完整:
|
|
实验记录 |
分析或计算结果 |
|
现象 |
硬质管内绿色变为红棕色; |
生成物有 |
|
干燥管B中晶体白色变蓝色。 |
生成物有H2O |
|
|
数据 |
称取绿矾样品16.68g; |
反应的绿矾0.06mol |
|
干燥管E最后增重2.24g; |
生成SO2 mol |
|
|
C中生成白色沉淀的质量为4.66g; |
生成DO3
0.02mol |
(4)该实验所得到的数据与所样到的化学方程式中的定量关系不相符合,请分析可能的原因
。
(5)为达到“验证绿矾受热分解是否发生上述反应”的目的,该实验的设计有多处不妥,请提出改进建议(两条即可)
。
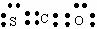
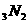
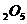 冶炼钒,铝作氧化剂
冶炼钒,铝作氧化剂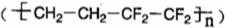 是由两种单体加聚而成的
是由两种单体加聚而成的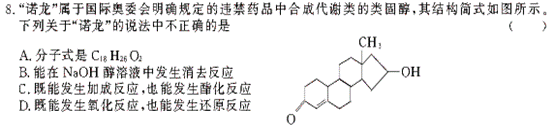
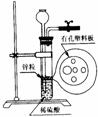 右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )