5.下列离子方程式正确的是
A.在硫酸铜溶液中加入过量氢氧化钡溶液:Ba2++SO42-=BaSO4↓
B.碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
C.向氯化铝溶液中加入过量氨水:A13++4NH3·H2O A1O2-+4NH4++2H2O
A1O2-+4NH4++2H2O
D.NH4HCO3溶液与过量NaOH溶液混合后加热:NH4++OH-=NH3↑+H2O
|
① 酸性氧化物在一定条件下均能与碱发生反应② 弱酸与盐溶液反应可以生成强酸,
③ 发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成,
④ 两种酸溶液充分反应后,所得溶液呈中性,
⑤ 有单质参加的反应,但该反应不是氧化还原反应,
⑥ 两种氧化物发生反应有气体生成
A.①②③④⑤⑥ B.②④⑤⑥ C.①②③⑤ D.③④⑤⑥
26.(13分)Ⅰ.硫酸的消费量常被作为有关国家工业发达水平的一种标志,下表为接触法制硫酸时,温度和压强对SO2转化率的影响:
|
压强/MPa 温度/℃ |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
⑴硫酸工业在国民经济中占有重要的地位,请写出它的两种重要用途:
___________________、_____________________。
⑵工业中催化氧化SO2采用常压而不用高压,理由是___________________________________
_______________________________________。
Ⅱ.实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并收集得到SO3。已知SO3熔点为16.8℃,沸点44.8℃,且SO3遇水剧烈反应。
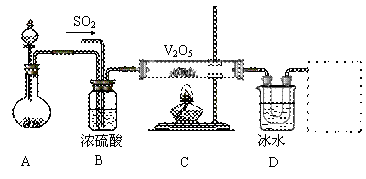
⑴写出A装置中制取氧气的化学方程式__________________________________。
⑵B装置的作用除了将气体充分混合外,还有:
①________________________________,②_________________________________。
⑶加热硬质玻璃管时,若不断升高温度,对SO2和O2生成SO3的化学反应有何影响:
_____________________________________________________________。
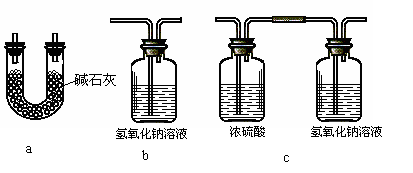
⑷本实验装置虚框处还需接一装置,甲、乙、丙三同学分别设计了a、b、c三套装置,你认为不合理的是________,理由是______________________________________。