1.下列金属冶炼的反应原理,错误的是
|
A.2NaCl(熔融) === 2Na + Cl2↑
|
|
C.Fe3O4 + 4CO === 3Fe + 4CO2 D.2CuO === 2Cu + O2↑
12.(16分)工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:①NH3+CO2+H2O=NH4HCO3…②NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl…
将所得碳酸氢钠晶体加热分解后即可得到纯碱。请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因 ______________
。
(2)现有甲、乙、丙三个小组学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
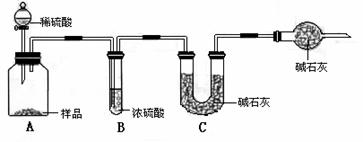 甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
乙组:取10.00g样品,配成1000mL
溶液,用碱式滴定管量取25.00mL放
入锥形瓶中,加入甲基橙作指示剂,
用0.150mol·L-1的标准盐酸溶液滴定
至终点(有关反应为Na2CO3+2HCl
=2NaCl+H2O+CO2↑)。完成三次平行实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至
所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
|
分析与 计算 分组 |
计算样品中碳酸钠 的质量分数 |
对实验结果 的评价 |
实验失败的主要原因 及对结果的影响 |
|
甲组 |
|
失败 |
|
|
乙组 |
|
成功 |
-------- |
|
丙组 |
|
成功 |
-------- |
附加题
10.(16分)某种含有少量氧化纳的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用下图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
(1)写出Na2O2和H2O反应的化学方程式 。(2)计算过氧化钠质量分数时,必需的数据是 。不必做第6次读数的原因是 。
(3)测定上述样品(1.560g)中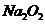 质量分数的另一种方案,其操作流程如下:
质量分数的另一种方案,其操作流程如下:
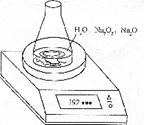
|
操 作 Ⅰ → 溶液转移 → 操作Ⅱ → 称量
①操作Ⅱ的名称是 。
②需直接测定的物理量是 。
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 (固定、夹持仪器除外)。④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果 (填偏大、偏小或不变)
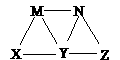
9.此题包括两小题Ⅰ(8分)下图中A至F是化合物,G是单质.写出A、B、E、F的化学式A _____ B _____ E ______ F ____

 Ⅱ(8分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
Ⅱ(8分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。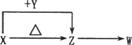 请回答:
请回答:
(1)X与Y在溶液中反应的离子方程式是 。
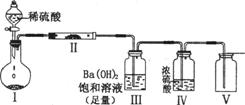
(2)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物利用上图装置(夹持固定装置己略去)进行实验,装置Ⅲ中生成白色沉淀,装置V中可收集到一种无色气体。
装置I中反应的化学方程式是 。
装置Ⅱ中反应的化学方程式是 。
装置Ⅲ中反应的化学方程式是 。
|
|
读数次数 |
质量/g |
|
锥形瓶 +水 +试样 |
第1次 |
192.214 |
|
第2次 |
192.164 |
|
|
第3次 |
192
028 |
|
|
第4次 |
192.010 |
|
|
第5次 |
192.010 |
 A.X一定是碳酸钠溶液
A.X一定是碳酸钠溶液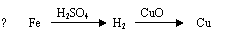
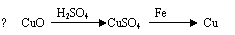
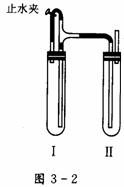 (3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是__
。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是__
。 请回答该实验中的问题。
请回答该实验中的问题。 (不用写计算过程)。
(不用写计算过程)。