6.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是:
|
|
50ml盐酸 |
50ml盐酸 |
50ml盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
A.盐酸的物质的量浓度为3.0mol·L-1 B.根据表中数据可以计算出混合物中NaHCO3的质量分数 C.加入混合物9.2g时盐酸过量 D.15.7g混合物恰好与盐酸完全反应
12.(16分)工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:①NH3+CO2+H2O=NH4HCO3…②NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl…
将所得碳酸氢钠晶体加热分解后即可得到纯碱。请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因 ______________
。
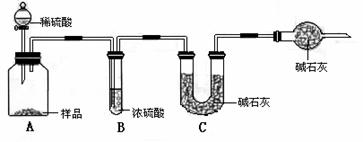
(2)现有甲、乙、丙三个小组学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
 乙组:取10.00g样品,配成1000mL
乙组:取10.00g样品,配成1000mL
溶液,用碱式滴定管量取25.00mL放
入锥形瓶中,加入甲基橙作指示剂,
用0.150mol·L-1的标准盐酸溶液滴定
至终点(有关反应为Na2CO3+2HCl
=2NaCl+H2O+CO2↑)。完成三次平行实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至
所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
|
分析与 计算 分组 |
计算样品中碳酸钠 的质量分数 |
对实验结果 的评价 |
实验失败的主要原因 及对结果的影响 |
|
甲组 |
|
失败 |
|
|
乙组 |
|
成功 |
-------- |
|
丙组 |
|
成功 |
-------- |
附加题
 的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100
的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100 水,搅拌,使固体完全溶解,则甲、乙、丙、丁所得溶液里溶质的质量分数大小的顺序是( )
水,搅拌,使固体完全溶解,则甲、乙、丙、丁所得溶液里溶质的质量分数大小的顺序是( )
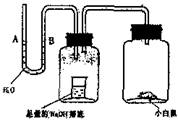 请据图回答,经数小时后,U型管(A)B两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)
请据图回答,经数小时后,U型管(A)B两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)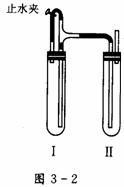 (2)除去蒸馏水中溶解的O2常采用____
____的方法。
(2)除去蒸馏水中溶解的O2常采用____
____的方法。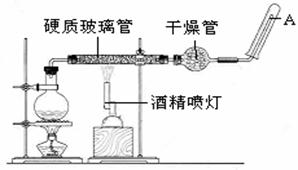
 (不用写计算过程)。
(不用写计算过程)。 (3)通过计算确定两种盐的化学式,写出计算和推理过程。
(3)通过计算确定两种盐的化学式,写出计算和推理过程。