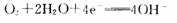4.某同学设计了一个研究水分对大豆发芽影响的实验:在①和②两个花盆中种了大豆,并对阳光、温度、水加以控制(如下表所示)。另一同学看了设计后提出下列意见,其中正确的是
|
花盆 |
阳光 |
温度 |
水 |
|
① |
向阳处 |
200 C |
充足 |
|
② |
暗室 |
200 C |
不充足 |
A.两个花盆都应放在向阳处 B.两个花盆的温度都应维持在0℃
C.两个花盆都应保证充足的水分 D.两个花盆都应给予不充足的水分
 B.表示光照强度与光合作用速率的关系
B.表示光照强度与光合作用速率的关系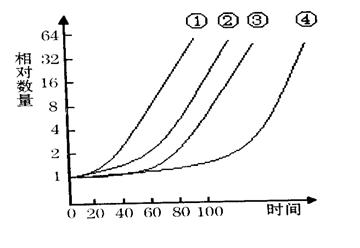
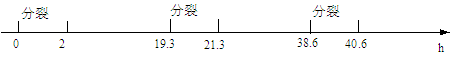 科学家用 15N 的硝酸盐作为标记物浸泡蚕豆幼苗,追踪蚕豆根尖细胞分裂情况,得到蚕豆根尖分生区细胞连续分裂的有关数据,如下图。下列叙述正确的是
科学家用 15N 的硝酸盐作为标记物浸泡蚕豆幼苗,追踪蚕豆根尖细胞分裂情况,得到蚕豆根尖分生区细胞连续分裂的有关数据,如下图。下列叙述正确的是 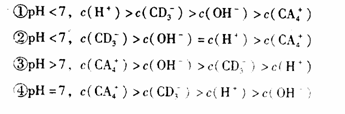
 (4)对可逆反应3A2(g) +C2(g)
(4)对可逆反应3A2(g) +C2(g) 2CA3
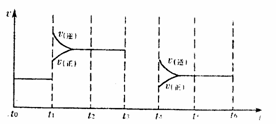
(g),当反应达到平衡时,不断改变条件(不改变A2、C2、CA3的量) ,如图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________________。
2CA3
(g),当反应达到平衡时,不断改变条件(不改变A2、C2、CA3的量) ,如图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________________。 

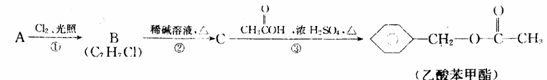
 t0时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂
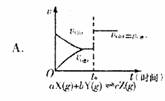
t0时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂 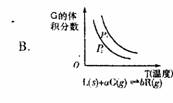 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
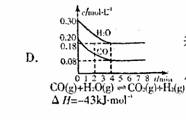 若该反应在850℃的l0L密闭容器中进行, 4min时, 反应放出51.6kJ的热量
若该反应在850℃的l0L密闭容器中进行, 4min时, 反应放出51.6kJ的热量 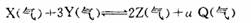 2 min达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L.下列叙述错误的是( )
2 min达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L.下列叙述错误的是( ) 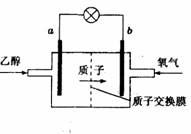 13.新型的乙醇电池结构如图所示,它用碘酸类质子溶剂.在 200°C左右时供电,其效率比甲醇电池高出32倍,且更安全。 已知电池总反应式为
13.新型的乙醇电池结构如图所示,它用碘酸类质子溶剂.在 200°C左右时供电,其效率比甲醇电池高出32倍,且更安全。 已知电池总反应式为 下 列说法不正确的是
下 列说法不正确的是