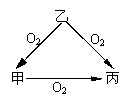
 17(5分). 常温下某种淡黄色固体甲,与它的气态氢化物乙和氧化物丙之间有如图的转化关系。试回答下列问题:
17(5分). 常温下某种淡黄色固体甲,与它的气态氢化物乙和氧化物丙之间有如图的转化关系。试回答下列问题:
(1)甲是_ S____,乙是_H2S_______,丙是__SO2____。
(2)乙和丙发生反应时,无论乙和丙的物质的量之比如何,反应
得到的氧化产物与还原产物的质量比都是 2:1 。
18(12分).用A、B两种常见化合物组成的混合物,其焰色反应均
为黄色,其相互关系如图(其他物质均略去)。
|
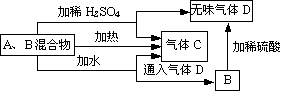

 已知:2B E+D+H2O. 根据上图关系,回答下列问题:
(1)写出A、B、C、D的化学式:A__Na2O2___,B__NaHCO3___,C_O2____,D_CO2___。
(2)写出A与水反应的化学方程式:__2Na2O2+2H2O==4NaOH+O2___。
(3)加热后,若只得到一种固态化合物,则A与B的物质的量之比的最大值为_39/84__。
已知:2B E+D+H2O. 根据上图关系,回答下列问题:
(1)写出A、B、C、D的化学式:A__Na2O2___,B__NaHCO3___,C_O2____,D_CO2___。
(2)写出A与水反应的化学方程式:__2Na2O2+2H2O==4NaOH+O2___。
(3)加热后,若只得到一种固态化合物,则A与B的物质的量之比的最大值为_39/84__。
19(11分)。下表是元素周期表的一部分,回答下列有关问题:
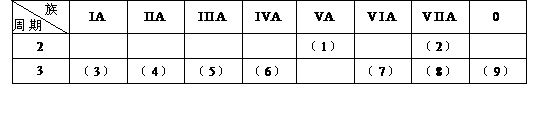
1在这些元素中,最活泼的金属元素是(写元素符号,下同)__Na _,最活泼的非金属元素是__F__,最不活泼的元素是__Ar__。
2在这些元素的最高价氧化物对应水化物中,酸性最强的是_HClO4__,碱性最强的是__NaOH_,呈两性的氢氧化物是_Al(OH)3__,写出三者之间相互反应的化学方程式__ Al(OH)3+_3HClO4===_Al(ClO4)3_+3H2O___, Al(OH)3+NaOH===NaAlO2+2H2O .
3在这些元素中,原子半径最大的是_Na__,原子半径最小的是__F__。
4在(3)与(4)中,化学性质较活泼的是__Na__.
20(10分)。A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为1∶1和1∶2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(1)写出元素符号:B_F____,D__Mg____。
(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式
_ _2Na2O2_+2 CO2===2Na2CO3+O2 __。
 (3)1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式__2F2+2NaOH===2NaF+OF2 +H2O_____。
(3)1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式__2F2+2NaOH===2NaF+OF2 +H2O_____。
(4)B、C形成的化合物的电子式为___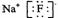 _____。
_____。

|

25、(9分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
- |
I.⑴某同学根据数据推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的推测是否合理?答:_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______________。
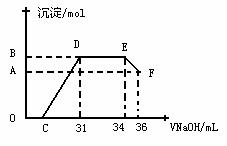 II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
⑴图中OC段没有沉淀生成,此阶段
发生反应的离子方程式为 。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ;
⑶B与A的差值为 mol。
⑷B点对应沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL
|
姓名 学号 得分
第Ⅱ卷(非选择题 共86分)
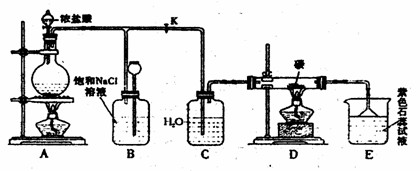

 (2)实验开始先点燃A处的酒精灯,打开旋 塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式__2Cl2+2H2O+C CO2+4HCl___;装置C的作用是
(2)实验开始先点燃A处的酒精灯,打开旋 塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式__2Cl2+2H2O+C CO2+4HCl___;装置C的作用是