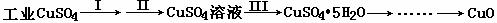0 37466 37474 37480 37484 37490 37492 37496 37502 37504 37510 37516 37520 37522 37526 37532 37534 37540 37544 37546 37550 37552 37556 37558 37560 37561 37562 37564 37565 37566 37568 37570 37574 37576 37580 37582 37586 37592 37594 37600 37604 37606 37610 37616 37622 37624 37630 37634 37636 37642 37646 37652 37660 447348
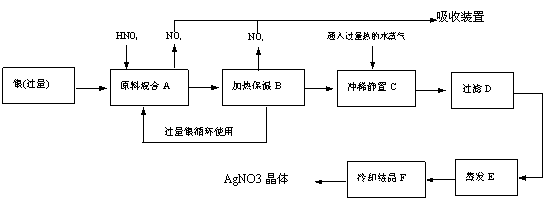 某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下
某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
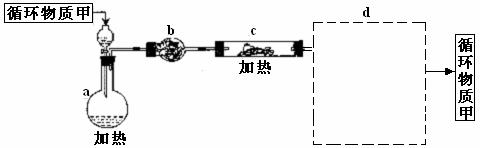
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验: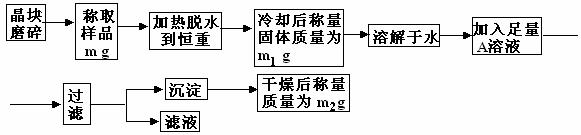 (1)晶块磨碎时使用的仪器名称 ,加热脱水时使用的容器名称 ,若加热过程中有固体飞溅出来造成损失,则会使测得结晶水的含量偏 。
(1)晶块磨碎时使用的仪器名称 ,加热脱水时使用的容器名称 ,若加热过程中有固体飞溅出来造成损失,则会使测得结晶水的含量偏 。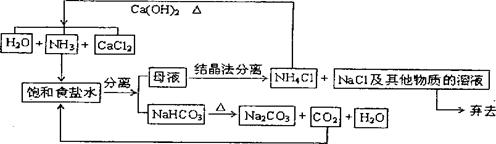
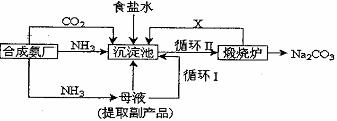 我国化学家侯德榜改革国外的纯碱生产工艺,创造了侯德榜制碱法又叫联碱法,生产流程可简要表示如下:
我国化学家侯德榜改革国外的纯碱生产工艺,创造了侯德榜制碱法又叫联碱法,生产流程可简要表示如下:
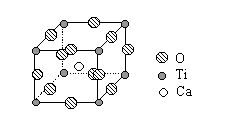 (2)钛的一种超导化合物--钙钛矿晶体中最小重复单元(晶胞)的结构如右图。请回答:
(2)钛的一种超导化合物--钙钛矿晶体中最小重复单元(晶胞)的结构如右图。请回答:
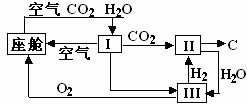
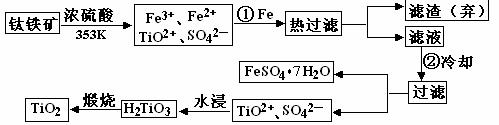
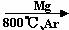 ⑶
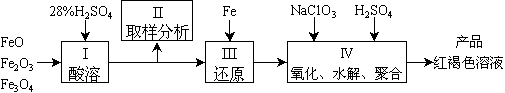
上述制备TiO2的过程中,可以利用的副产物是___________;考虑成本和废物综合利用因素,废液中应加入_________________处理。
⑶
上述制备TiO2的过程中,可以利用的副产物是___________;考虑成本和废物综合利用因素,废液中应加入_________________处理。