|
(1)该盐酸的物质的量浓度为多少?(列式计算)
(2)取40gMnO2与该盐酸在加热条件下反应,欲制得标准状况下的氯气8.96L,取该盐酸的体积至少为 mL。
(3)用所得氯气制取漂白粉,求漂白粉的质量。
28.(9分)生活中,人们越来越注意微量元素的摄入,碘元素对人体健康与发育有着至关重要的作用。若缺少碘元素,则会造成幼儿痴呆、发育不良,易患地方性甲状腺肿。为了预防碘缺乏病,我国卫生部规定每千克食盐中应含有40mg~50mg的碘酸钾。据此回答下列问题:
 (1)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定的电流强度和温度下电解KI溶液。总反应化学方程式为
(1)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定的电流强度和温度下电解KI溶液。总反应化学方程式为
KI+3H2O KIO3+3H2↑。阳极反应式为
。
(2)为检验某食盐中是否含有碘酸钾。某同学取食盐样品428g溶解后,加入盐酸酸化的淀粉碘化钾溶液,溶液呈蓝色。反应的离子方程式为
该反应中氧化产物与还原产物的物质的量之比为 。
(3)为进一步验证该样品是否为合格产品,该生再用0.030mol/L的硫代硫酸钠溶液对上述溶液进行滴定,当用去18.00mL时蓝色刚好又褪去(I2+2S2O32-====S4O62-+2I-),计算得每千克该加碘盐中碘酸钾的含量为 ,该加碘食盐为
(填“合格”或“不合格”)食盐。
26、(10分)已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
|
粒子代码 |
a |
I |
e |
|
原子核数 |
单核 |
四核 |
双核 |
|
粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①-⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
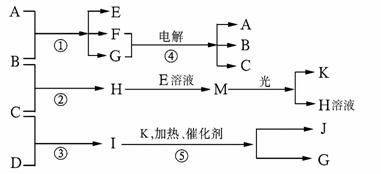
请填写下列空白:
(1)写出下列物质的化学式:B: ;J:_________。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为
。
 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ根据以上信息和数据,下列说法正确的是 2C(g),△H<0。
2C(g),△H<0。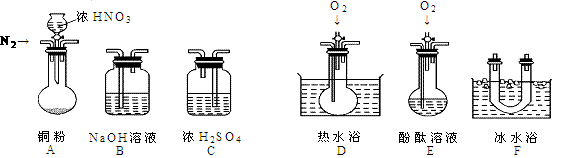
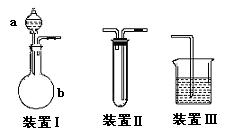 (12分)化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能。
(12分)化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能。 (2)乙同学认为装置Ⅰ可作为实验室制氧气的快速发生器,对装置Ⅱ稍作改进后即可作为O2的收集装置,乙同学对装置Ⅱ的改进方法是:_________________________,制O2时在装置Ⅰ中的a中加入________________,b仪器中加入__________________。
(2)乙同学认为装置Ⅰ可作为实验室制氧气的快速发生器,对装置Ⅱ稍作改进后即可作为O2的收集装置,乙同学对装置Ⅱ的改进方法是:_________________________,制O2时在装置Ⅰ中的a中加入________________,b仪器中加入__________________。