1.石油是一种重要能源,人类正面临着石油短缺,油价上涨的困惑。以下解决能源问题的方法不当的是 ( )
A.大量使用木材作燃料
B.推广使用乙醇汽油,即在汽油中掺入适量乙醇
C.开发风能
D.开发太阳能
18、某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
|
|
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
|
m(混合物) |
9.2 g |
15.7 g |
27.6 g |
|
V(CO2)(标况) |
2.24 L |
3.36 L |
3.36 L |
则下列分析推理中不正确的是
A.盐酸的物质的量浓度为3.0 mol·L-1
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2 g时盐酸过量
D.15.7 g混合物恰好与盐酸完全反应
第II卷(非选择题,共78分)
 (10分) 将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共Amol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOHBmol。(有关反应方程式:①N2O4 2 NO2 ;②2NO2+2NaOH=NaNO2+NaNO3+H2O
;③NO+NO2+2NaOH=2NaNO2+H2O)
(10分) 将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共Amol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOHBmol。(有关反应方程式:①N2O4 2 NO2 ;②2NO2+2NaOH=NaNO2+NaNO3+H2O
;③NO+NO2+2NaOH=2NaNO2+H2O)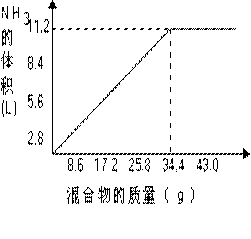 (8分)在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4固体混合物,加热充分反应。如图表示加入的混合物质量和产生的气体体积(标况)的关系。试计算:
(1)NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积(标况)为多少升?
(3)当NaOH溶液的体积为180mL ,固体混合物的质量仍为51.6g时,充分反应后,生成气体的体积(标况)为多少升?
(8分)在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4固体混合物,加热充分反应。如图表示加入的混合物质量和产生的气体体积(标况)的关系。试计算:
(1)NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积(标况)为多少升?
(3)当NaOH溶液的体积为180mL ,固体混合物的质量仍为51.6g时,充分反应后,生成气体的体积(标况)为多少升?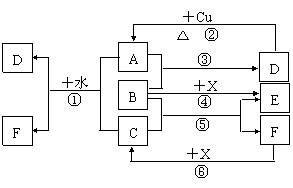 已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。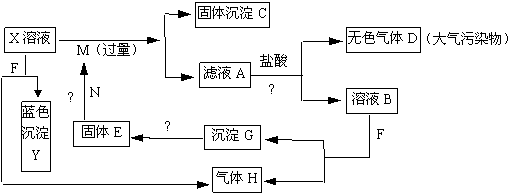
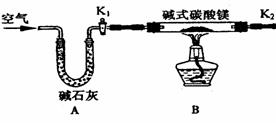
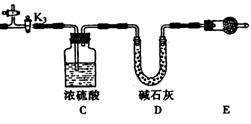
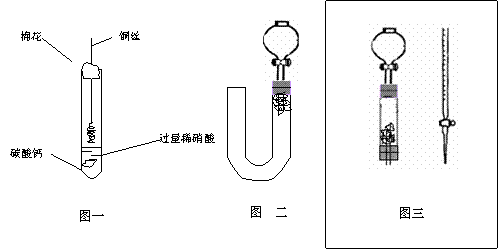
 ②反应开始后,因为随着NO的体积增加,
②反应开始后,因为随着NO的体积增加,