19.(8分)(1)在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2+O2 2SO3,
2SO3,
ΔH<0,已知常压下平衡混合气体中SO3体积分数为91%。试回答:
①在生产中常用过量的空气是为了____________________________ __,加热到400℃-500℃是由于______________________________ ___ ____。
②常用浓H2SO4来吸收SO3而不用水,因为______________ ______________。
③用浓硫酸吸收SO3可以得到H2SO4·SO3。若用1kg98%的浓硫酸充分吸收SO3后,再进行稀释,可得到98%的浓硫酸的质量为 。(2.22kg)
(2)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
①预测C-C键的键能,在“C-C、C-Si、Si-Si”中键能最大的为: 。
②计算反应SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)的反应热△H = kJ•mol-1。 [答案] (1)增大氧气浓度,提高成本较高的SO2的转化率 (2)在此温度下,催化剂活性强,反应速率快,可缩短到达平衡的时间,提高单位时间内SO3的产率 (3)用水吸收易形成酸雾,降低吸收速率;防止空气污染
答案:(8分,每空2分)(1)C-C,+236
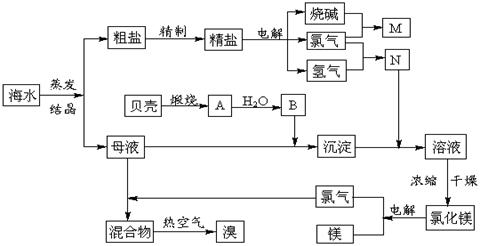
 (4)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是
。
(4)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是
。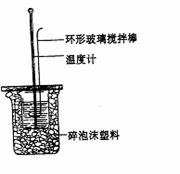 (10分)用50mL、0.50 mol ·L-1的盐酸与50mL、0.55 mol ·L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(10分)用50mL、0.50 mol ·L-1的盐酸与50mL、0.55 mol ·L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题: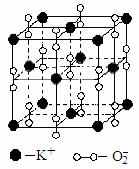 高温下,超氧化钾晶体呈立方体结构。晶体中氧的
高温下,超氧化钾晶体呈立方体结构。晶体中氧的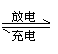 已知蓄电池在放电时起原电池的作用,充电时起电解池的作用,铅蓄电池在放电和充电时发生的化学反应可用下式表示:
已知蓄电池在放电时起原电池的作用,充电时起电解池的作用,铅蓄电池在放电和充电时发生的化学反应可用下式表示: