|
量的名称 |
符号 |
单 位 |
涵 义 |
说 明 |
|
相对原子质量(原子量) |
Ar |
国际单位制 (SI) 单位为1 |
元素的一个原子的质量对碳-12原子质量的1/12之比 |
原子的质量、质量数均不同于原子量 |
|
相对分子质量(化学式量) |
Mr |
同上 |
化学式中各原子的相对原子量和其原子数的乘积之和 |
通常用分子量表示 |
|
物质的量 |
n |
摩尔(mol) |
摩尔是表示物质的量的单位。每摩尔物质含有阿伏加德罗常数个微粒。 |
微观粒子包括原子、分子、离子、电子等以及它们的特定组合 |
|
摩尔质量 |
M |
g/mol |
1摩尔物质的质量 |
数值上等于该元素的原子量或物质的化学式量 |
|
气体摩尔体积 |
Vm |
L/mol |
在标准状况下(0℃, 101.3kPa),1mol任何气体的体积都约为22.4L。 |
Vm的大小与温度和压强有关 |
|
物质的量浓度 |
C |
mol/L |
1L溶液中含有溶质的物质的量 |
|

 ÷摩尔质量
22.4L·mol-1÷
÷摩尔质量
22.4L·mol-1÷

 质量
物质的量
体积[气体体积(标准状况)]
质量
物质的量
体积[气体体积(标准状况)]
 ÷ 溶液
÷ 溶液 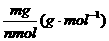


 固体
固体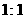 的硫酸制取
的硫酸制取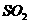 气体,通常可以对(1)中制气装置进行怎样的简单改动? 。b中的液体一般应选用
。
气体,通常可以对(1)中制气装置进行怎样的简单改动? 。b中的液体一般应选用
。
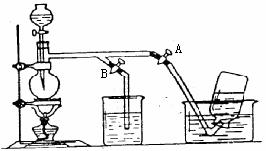
 溶液
溶液