摘要:化学平衡状态 (1)概念:在一定条件下的可逆反应里.正反应速率和逆反应速率相等.反应混合物中各组分的质量分数保持不变的状态. (2)特征 ①逆:研究对象可逆反应. ②等:V(正)=V(逆)≠O ③动:化学平衡是动态平衡.虽然V(正)=V(逆).但正.逆反应仍在进行.其反应速率不等于零. ④定:各组分的质量分数一定. ⑤变:外界条件改变.平衡也随之改变. ⑥无:化学平衡的建立与反应从哪个方向开始无关.
网址:http://m.1010jiajiao.com/timu3_id_363693[举报]
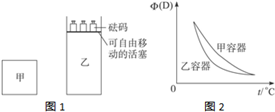 当温度不变的情况下,有反应:2A(g)+2B(g)?C(g)+3D(g),△H<0.现将2mol A和2mol B充入体积为V的甲容器,将2mol C和6mol D充入乙容器并使乙容器在反应开始前体积为2V(如图1).关于两容器中反应的说法正确的是( )
当温度不变的情况下,有反应:2A(g)+2B(g)?C(g)+3D(g),△H<0.现将2mol A和2mol B充入体积为V的甲容器,将2mol C和6mol D充入乙容器并使乙容器在反应开始前体积为2V(如图1).关于两容器中反应的说法正确的是( )
查看习题详情和答案>>
高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0
其平衡常数可表示为K=c(CO2)/c(CO),已知1 100℃时K=0.263,且化学平衡常数只与温度有关,不随浓度和压强的变化而变化.
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值
(2)1 100℃时测得高炉中c(CO2)=0.025mol?L-1,c(CO)=0.1mol?L-1,在这种情况下,该反应是否处于化学平衡状态
(3)试通过计算当20L的高炉中,通入10molCO和矿石在1 100℃时达平衡时,CO的转化率?
查看习题详情和答案>>
其平衡常数可表示为K=c(CO2)/c(CO),已知1 100℃时K=0.263,且化学平衡常数只与温度有关,不随浓度和压强的变化而变化.
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值
增大
增大
,平衡常数K值增大
增大
(均填“增大”、“减小”或“不变”).(2)1 100℃时测得高炉中c(CO2)=0.025mol?L-1,c(CO)=0.1mol?L-1,在这种情况下,该反应是否处于化学平衡状态
否
否
(填“是”或“否”).此时,化学反应速率是v正大于
大于
v逆(填“大于”、“小于”或“等于”),其原因是因难度商Qc=
=
=0.25<K=0.263,温度不变,K值不变,为增大
比值,v(正)大于v(逆)
| c(CO2) |
| c(CO) |
| 0.025mol/L |
| 0.1mol/L |
| c(CO2) |
| c(CO) |
因难度商Qc=
=
=0.25<K=0.263,温度不变,K值不变,为增大
比值,v(正)大于v(逆)
.| c(CO2) |
| c(CO) |
| 0.025mol/L |
| 0.1mol/L |
| c(CO2) |
| c(CO) |
(3)试通过计算当20L的高炉中,通入10molCO和矿石在1 100℃时达平衡时,CO的转化率?
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其平衡常数K与温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
.
(2)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
查看习题详情和答案>>
| T | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
| C(CO)?C(H2O) |
| C(CO2)?C(H2) |
| C(CO)?C(H2O) |
| C(CO2)?C(H2) |
(2)能判断该反应是否达到化学平衡状态的依据是
bc
bc
(多选扣分).a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
830
830
℃.在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态否
否
(是或否)处于平衡状态?若不是,反应向哪个方向进行?反应向正反应方向进行
反应向正反应方向进行
. 2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应.下列有关说法正确的是( )
2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应.下列有关说法正确的是( )