26、(10分)在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如下(气体体积均为标准状况下测得):
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
255 |
385 |
459 |
|
气体体积/mL |
280 |
336 |
336 |
(1)乙组实验中,盐酸 (填“过量”、“适量”或“不足量”),
理由是 。
(2)要计算盐酸的物质的量浓度,题中可做计算依据的是 。
(3)合金中Mg、Al的物质的量之比为 。
(4)在丙组实验后,向容器中加入1mol/L的NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,求所加NaOH溶液的体积。(写出计算过程)
24、(10分)某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗进行综合利用,不仅可以提高经济效益,而且还能防止环境污染。现按下列方式进行综合利用,回答问题。
|
|
|
||||||

 甘蔗渣 处理
水、△
酒化酶
甘蔗渣 处理
水、△
酒化酶

 催化剂
催化剂
在人体中 缓慢氧化 催化氧化
 C
△
C
△
|





 H
+D
新制Cu(OH)2
E 浓H2SO4 F
H
+D
新制Cu(OH)2
E 浓H2SO4 F
△浓H2SO4
已知F、H均是具有香味的液体,F为E的三聚合物,并具有特殊的6元环状对称结构。
⑴ A的名称 ;H的名称 ;
 ⑵
D
E的化学反应方程式 ;
⑵
D
E的化学反应方程式 ;
 ⑶ G H的化学反应方程式
;
⑶ G H的化学反应方程式
;
 ⑷
E
G的反应类型
。
⑷
E
G的反应类型
。
20、(12分)工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3……………………………………①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl………………②
将所得碳酸氢钠晶体加热分解后即可得到纯碱。请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因 ;
(2)现有甲、乙、丙三个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
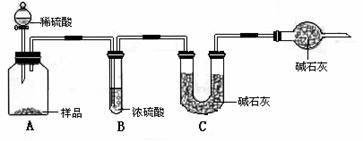
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2CaCl2+H2O+CO2↑)。完成三次实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。
请分析、计算后填表:
|
分析与 计算 分组 |
计算样品中碳酸钠 的质量分数 |
对实验结果 的评价 |
实验失败的主要原因 及对结果的影响 |
|
甲组 |
|
失败 |
|
|
乙组 |
|
成功 |
|
|
丙组 |
|
成功 |
|
