1.易燃、易爆、有毒等物质的包装上应贴L:危险警告标识。下面所列物质贴错了标识的是( )
|
|
A |
B |
C |
D |
|
物质的化学式 |
CCl4 |
NaOH |
CH3OH |
NH4NO3 |
|
危险警告标识 |
易燃品 |
腐蚀品 |
有毒品 |
爆炸品 |
20.(10分)分子筛可用于物质的分离提纯。某种型号的分子筛的工业生产流程可简单表示如下:
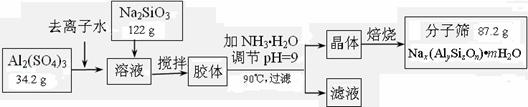
|
(1)在加NH3·H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)= ▲ 。
(2)生产流程中所得滤液的主要成分为 ▲ (写化学式)。
(3)假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10%,试通过计算确定该分子筛的化学式(写出计算过程)。
(4)分子筛的孔道直径为4Å称为4A型分子筛;当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65Å)和异丁烷(分子直径为5.6Å)应该选用 ▲ 型的分子筛。
18.(12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4] ―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
[方法一]还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
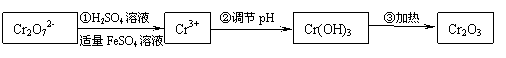

有关离子完全沉淀的pH如下表:
|
有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
|
完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 ▲ 。
(2)还原+6价铬还可选用以下的 ▲ 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。则在操作②中可用于调节溶液pH的试剂为: ▲ (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在 ▲ (填序号)最佳。
A.3-4 B.6-8 C.10-11 D.12-14
[方法二]电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极的电极反应式 ▲ 。
(5)电解法中加入氯化钠的作用是: ▲ 。
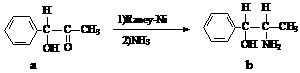

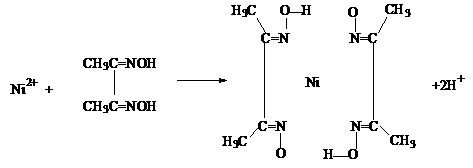
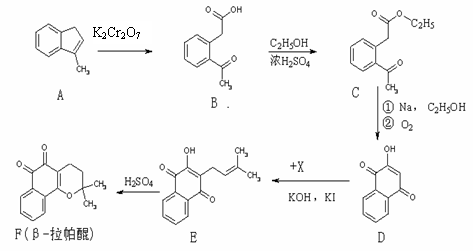

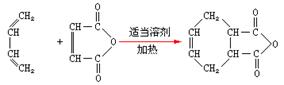 ,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子
,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子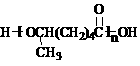 。
。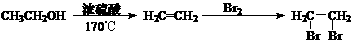
 H2O(l)+H2NCONH2
(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2
(l) △H=-103.7 kJ·mol-1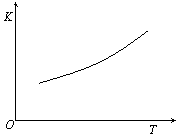

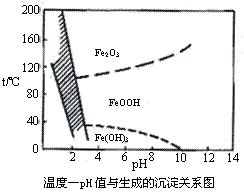 (3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2-4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。右图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10−39)。下列说法正确的是 ▲
(选填序号)。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2-4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。右图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10−39)。下列说法正确的是 ▲
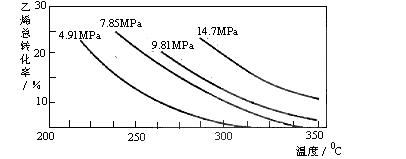
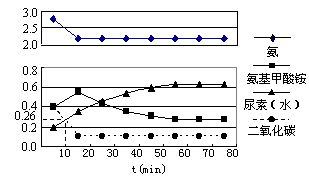
(选填序号)。 CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是